高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是:$\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)=2\text{S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\quad \Delta H\lt 0$。反应达到平衡后,改变某个条件,使平衡发生移动,得到下面的图像:
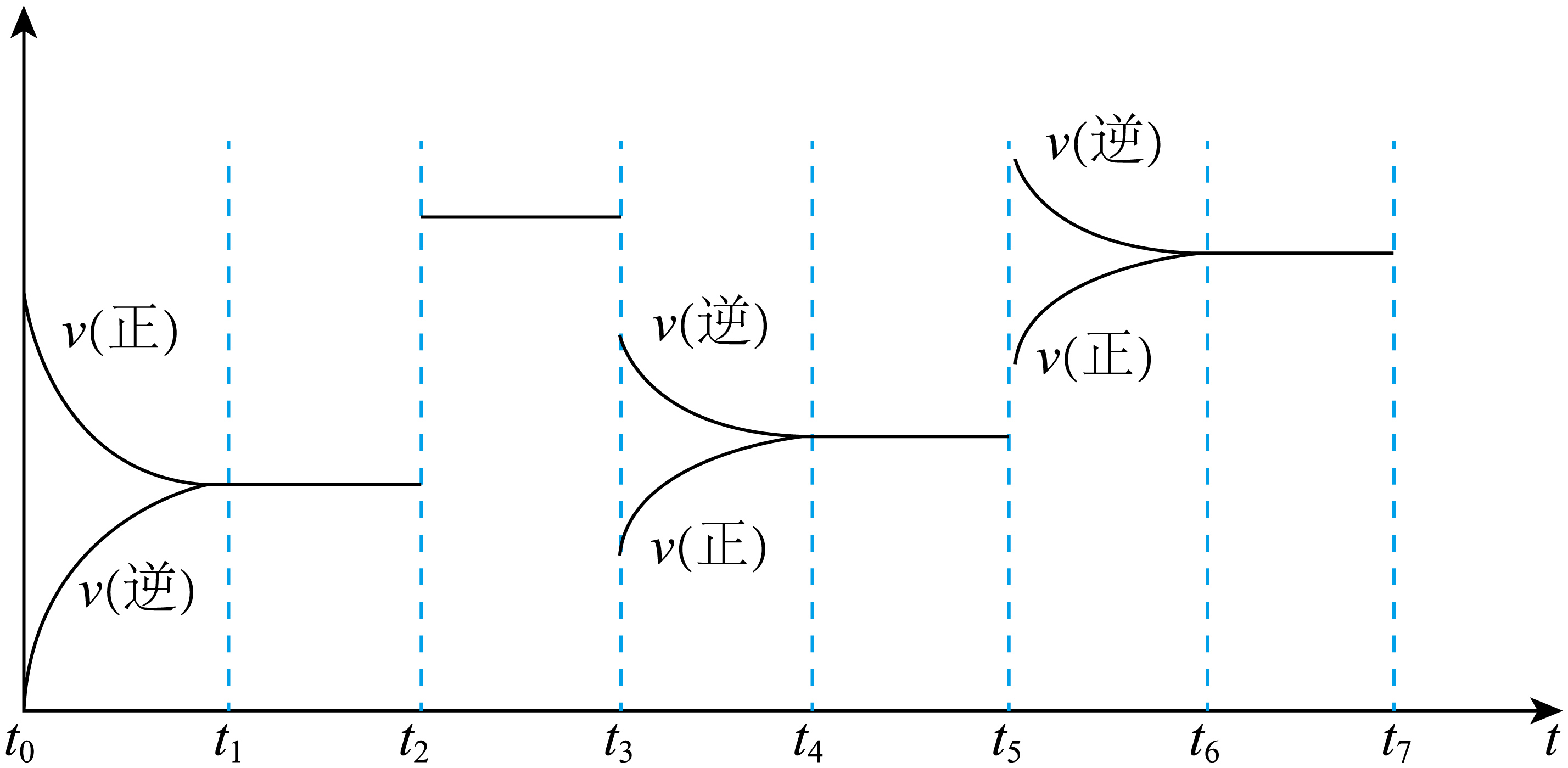
${{t}_{3}}$时刻改变的条件是 ;${{t}_{5}}$时刻改变的条件是 。
减小压强 ; 升高温度
"]]$t_3$时刻正逆反应速率均减小,且逆反应速率大于正反应速率,反应向逆反应方向进行,$\rm 2SO_{2}(g)+O_{2}(g)=2SO_{3}(g)$是气体分子数减小的反应,减小压强平衡逆向移动,则$t_3$时刻改变的条件是减小压强,${{t}_{5}}$时刻正逆反应速率均增大,平衡逆向移动,由于反应$\Delta H\lt 0$是放热反应,升高温度均能增大速率且平衡逆向移动,则${{t}_{5}}$时刻改变的条件是升高温度;
以上各时段的平衡状态中,$\rm SO_{2}$转化率最高的是 ;$\rm SO_{2}$浓度最小的是 。
${{t}_{1}}$至${{t}_{2}}$段 ; ${{t}_{4}}$至${{t}_{5}}$段
"]]若正反应速率大于逆反应速率,反应向正向进行,若$v(正)\lt v(逆)$,反应逆向进行,${{t}_{1}}$至${{t}_{2}}$段反应正向进行到达平衡状态,${{t}_{2}}$至${{t}_{3}}$段平衡不移动,${{t}_{3}}$至${{t}_{4}}$段平衡逆向移动,${{t}_{5}}$至${{t}_{6}}$段反应逆向进行,则$\rm SO_{2}$转化率最高的是${{t}_{1}}$至${{t}_{2}}$段,${{t}_{3}}$时刻通过增大体积来减小压强,则$\rm SO_{2}$浓度最小的是${{t}_{4}}$至${{t}_{5}}$段;
甲、乙、丙三个容器完全相同的恒容密闭容器,分别按照下表进行投料:
| 序号 | $\rm SO_{2}/mol$ | $\rm O_{2}/mol$ | $\rm SO_{3}/mol$ |
| 甲 | $\rm 2$ | $\rm 1$ | $\rm 0$ |
| 乙 | $\rm 3$ | $\rm 1$ | $\rm 0$ |
| 丙 | $\rm 2$ | $\rm 2$ | $\rm 0$ |
在相同温度下达到平衡后,三个容器中:$\rm SO_{2}$的转化率由大到小顺序为 。
丙$\\rm \\gt $甲$\\rm \\gt $乙
"]]容器乙对于容器甲而言,增大$\rm SO_{2}$的浓度,增加的$\rm SO_{2}$无法完全转化,导致转化率减小,$\rm SO_{2}$的转化率:甲$\rm \gt $乙,容器丙对于甲而言增大$\rm O_{2}$的浓度,提高$\rm SO_{2}$的转化率,则$\rm SO_{2}$的转化率:丙$\rm \gt $甲,因此三个容器中$\rm SO_{2}$的转化率由大到小顺序为:丙$\rm \gt $甲$\rm \gt $乙;
在容积为$\rm 2$ $\rm L$的密闭容器中充入$2\,\text{mol}\,\text{S}{{\text{O}}_{2}}$和一定量的$\rm O_{2}$进行上述反应,当反应进行到$\rm 4$ $\rm min$时,测得$n\left( \text{S}{{\text{O}}_{2}} \right)=0.4\,\text{mol}$,则反应进行到$\rm 2$ $\rm min$时,容器中:$\text{S}{{\text{O}}_{2}}$的物质的量为 。
$\rm A$.等于$\rm 1.6$ $\rm mol$ $\rm B$.等于$\rm 1.2$ $\rm mol$ $\rm C$.大于$\rm 1.6$ $\rm mol$ $\rm D$.小于$\rm 1.2$ $\rm mol$
$\\rm D$
"]]根据化学反应速率的概念可知,进行到$\rm 4$ $\rm min$时,测得$n\left( \text{S}{{\text{O}}_{2}} \right)=0.4\,\text{mol}$,此时反应的速率为$v(\text{S}{{\text{O}}_{2}})=\dfrac{\Delta c}{\Delta t}=\dfrac{\text{(2-0}\text{.4)}\,\text{mol}}{\text{2}\,\text{L}\times \text{4}\,\text{min}}=\text{0}\text{.2}\,\text{mol}\cdot {{\text{L}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}}$,反应进行到前$\rm 2$ $\rm min$末时设二氧化硫物质的量为$x$,进行到$\rm 2$ $\rm min$时的物质浓度大于$\rm 4$ $\rm min$时的物质的浓度,所以反应时$\rm 4$ $\rm min$的反应速率小于$\rm 2$ $\rm min$的反应速率,即$v\text{(S}{{\text{O}}_{\text{2}}}\text{)}=\dfrac{\Delta c}{\Delta t}=\dfrac{\text{(2-}x\text{)}\,\text{mol}}{\text{2}\,\text{L}\times \text{2}\,\text{min}}\text{0}\text{.2}\,\text{mol}\cdot {{\text{L}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}}$,整理得,$x\lt 1.2\,\text{mol}$。
高中 | 转化率、产率题目答案及解析(完整版)
