高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
在“碳达峰、碳中和”的目标引领下,对减少二氧化碳排放的相关技术研究正成为世界各国的前沿发展方向。回答下列问题:
利用$\text{C}{{\text{H}}_{4}}-\text{C}{{\text{O}}_{2}}$干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
$\rm I$.$\rm \text{C}{{\text{H}}_{4}}(\text{g})\rightleftharpoons \text{C}(\text{ads})+2{{\text{H}}_{2}}(\text{g})$
Ⅱ.$\rm \text{C}(\text{ads})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})$
上述反应中$\text{C}(\text{ads})$为吸附活性炭,反应历程的能量变化如图所示。
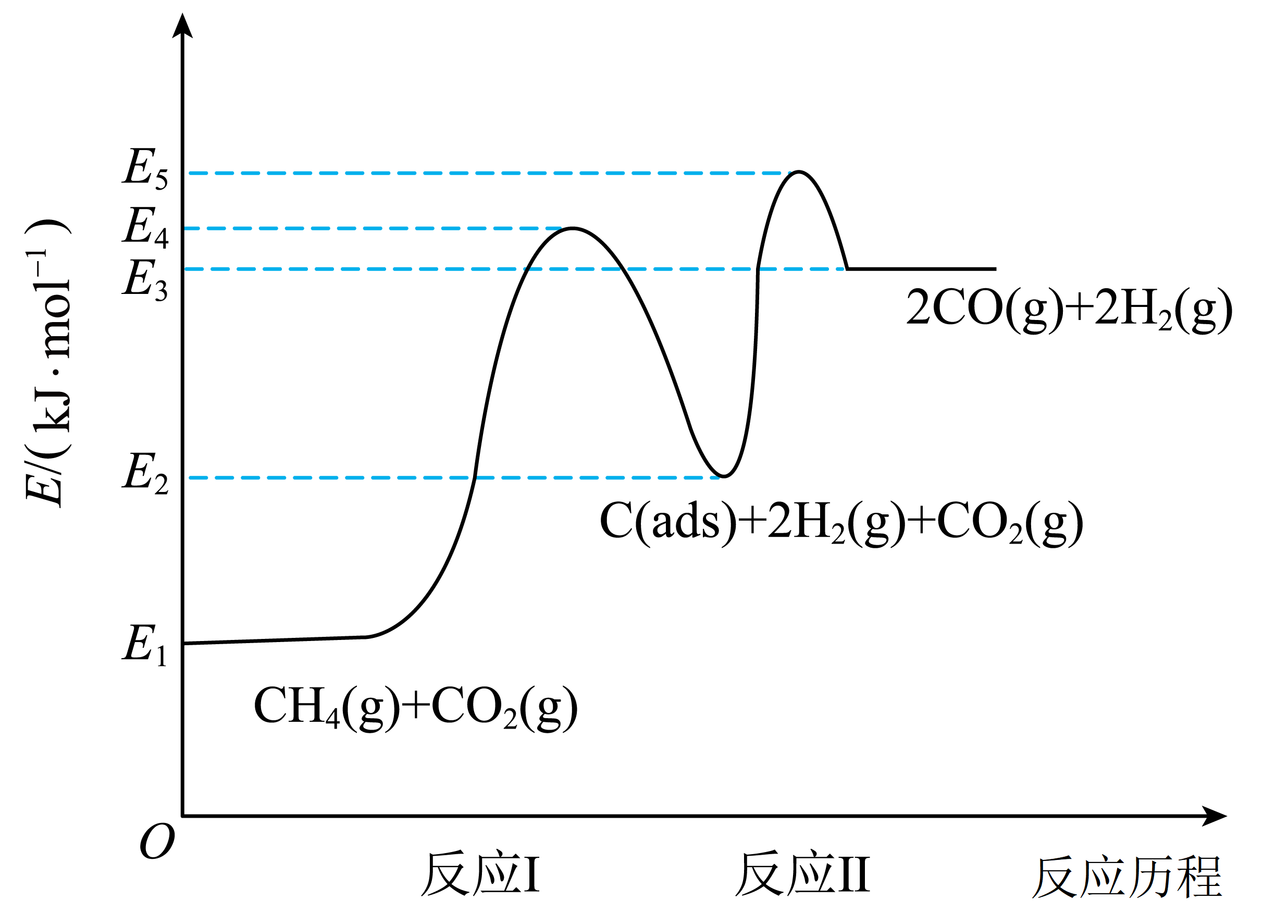
①反应Ⅱ是 $\rm ($填“慢反应”或“快反应”$\rm )$,$\text{C}{{\text{H}}_{4}}-\text{C}{{\text{O}}_{2}}$干重整反应的热化学方程式为 。$\rm ($选取图中${{{E}}_{{1}}}$、${{{E}}_{{2}}}$、${{{E}}_{{3}}}$、${{{E}}_{{4}}}$、${{{E}}_{{5}}}$表示反应热$\rm )$
②在恒压条件下,等物质的量的$\text{C}{{\text{H}}_{4}}(\text{g})$和$\text{C}{{\text{O}}_{2}}(\text{g})$发生干重整反应时,各物质的平衡转化率随温度变化如图所示。已知在干重整反应中还发生了副反应:
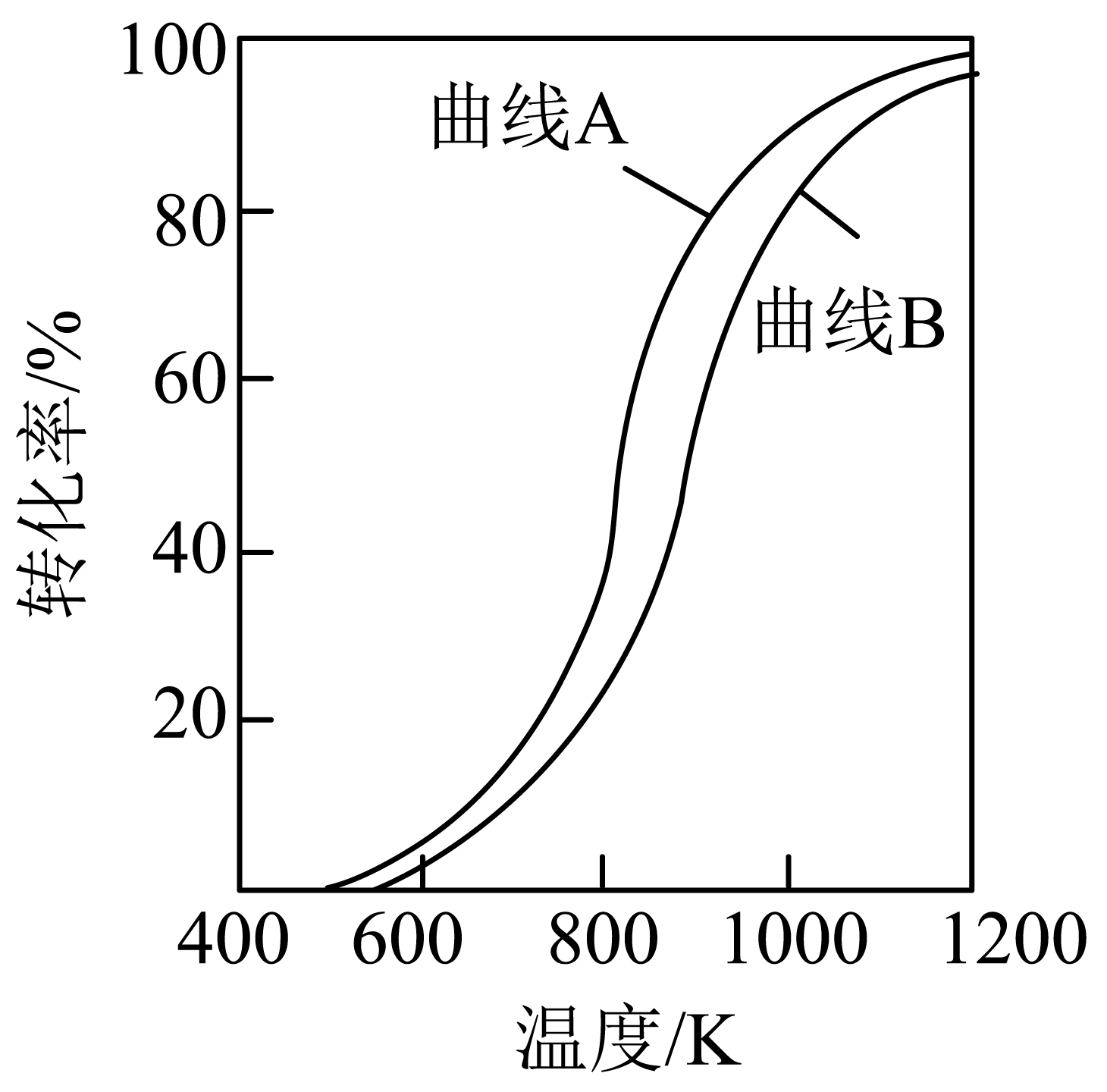
${{\text{H}}_{2}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons {{\text{H}}_{2}}\text{O}(\text{g})+\text{CO}(\text{g})\qquad \Delta {H}\gt 0$,则表示$\text{C}{{\text{H}}_{4}}$平衡转化率的是曲线 $\rm ($填“$\rm A$”或“$\rm B$”$\rm )$,判断的依据是 。
③在恒压$ {p}$、$800\text{ K}$条件下,在密闭容器中充入等物质的量的$\text{C}{{\text{H}}_{4}}(\text{g})$和$\text{C}{{\text{O}}_{2}}(\text{g})$,若曲线$\rm A$对应物质的平衡转化率为$40\%$,曲线$\rm B$对应物质的平衡转化率为$20\%$,则以上反应平衡体系中$ {n}(\text{CO}): {n}\left( {{\text{H}}_{2}}\text{O} \right)=$ ,干重整反应的平衡常数${{ {K}}_{\text{p}}}=$ $\rm ($用平衡分压代替平衡浓度表示,分压$\rm =$总压$\rm \times $物质的量分数,列出计算式,无需化简$\rm )$。
快反应;$\\text{C}{{\\text{H}}_{4}}(\\text{g})+\\text{C}{{\\text{O}}_{2}}(\\text{g})\\rightleftharpoons 2\\text{CO}(\\text{g})+2{{\\text{H}}_{2}}(\\text{g})\\qquad \\Delta {H}=+\\left( {{ {E}}_{3}}-{{ {E}}_{1}} \\right)\\text{ kJ}\\cdot \\text{mol}$;$\\rm B$;相同条件下,因为$\\text{C}{{\\text{O}}_{2}}$同时参与$\\rm 2$个反应,故转化率更大,$\\text{C}{{\\text{H}}_{4}}$只参与$\\rm 1$个反应,转化率小于$\\text{C}{{\\text{O}}_{2}}$;$3:1$;$\\dfrac{{{\\left( \\dfrac{0.6{p}}{2.4} \\right)}^{2}}\\cdot {{\\left( \\dfrac{0.2{p}}{2.4} \\right)}^{2}}}{\\left( \\dfrac{0.8{p}}{2.4} \\right)\\cdot \\left( \\dfrac{0.6{p}}{2.4} \\right)}$
"]]①由图可知反应$\rm I$的活化能大于反应Ⅱ,故反应Ⅱ为快反应,由图可知$\rm CH_{4}-CO_{2}$干重整反应的热化学方程式为$\text{C}{{\text{H}}_{4}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\qquad \Delta {H}=+\left( {{ {E}}_{3}}-{{ {E}}_{1}} \right)\text{ kJ}\cdot \text{mol}$;
②相同条件下,等物质的量的$\rm CH_{4}(g)$和$\rm CO_{2}(g)$发生干重整反应时,发生的反应为:$\rm CH_{4}(g)\rm +CO_{2}\rm (g)\rm =2CO(g)\rm +2H_{2}\rm (g)($主反应$\rm )$,$\rm H_{2}(g)+CO_{2}(g)=H_{2}O(g)+CO(g)\rm ($副反应$\rm )$,相同条件下,因为$\rm CO_{2}$同时参与$\rm 2$个反应,故转化率更大,$\rm CH_{4}$只参与$\rm 1$个反应,转化率小于$\rm CO_{2}$,则表示$\rm CO_{2}$平衡转化率的是曲线$\rm A$,表示$\rm CH_{4}$平衡转化率的是曲线$\rm B$;
③设在密闭容器中充入$\rm 1\;\rm mol$ $\rm CH_{4}(g)$和$\rm 1\;\rm mol$ $\rm CO_{2}(g)$,因为$\rm CO_{2}(g)$的转化率为$\rm 40\%$,消耗$\rm 0.4\;\rm mol$,$\rm CH_{4}(g)$的平衡转化率为$\rm 20\%$,故共消耗$\rm 0.2\;\rm mol$,列出三段式:
$\begin{matrix} {} \\起始 \text{(mol)} \\转化 \text{(mol)} \\平衡 \text{(mol)} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{4}}}\text{(g)} \\ \text{1} \\ 0.2 \\ 0.8 \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ 1 \\ 0.2 \\ 0.8 \\ \end{matrix}\begin{matrix} \overset{{}}{\mathop{\rightleftharpoons }}\, \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2CO(g)} \\ \text{0} \\ 0.4 \\ 0.4 \\ \end{matrix}\begin{matrix} \text{+2}{{\text{H}}_{\text{2}}}\text{(g)} \\ 0 \\ 0.4 \\ 0.4 \\ \end{matrix}$
$\begin{matrix} {} \\起始 \text{(mol)} \\转化 \text{(mol)} \\平衡 \text{(mol)} \\ \end{matrix}\begin{matrix} {{\text{H}}_{2}}\text{(g)} \\ 0.4 \\ 0.2 \\ 0.2 \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ 0.8 \\ 0.2 \\ 0.6 \\ \end{matrix}\begin{matrix} \overset{{}}{\mathop{\rightleftharpoons }}\, \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{CO(g)} \\ 0.4 \\ 0.2 \\ 0.6 \\ \end{matrix}\begin{matrix} +{{\text{H}}_{\text{2}}}\text{O(g)} \\ 0 \\ 0.2 \\ 0.2 \\ \end{matrix}$
平衡时体系中,$n\rm (CH_{4})=0.8\;\rm mol$,$n\rm (CO_{2})=0.6\;\rm mol$,$n\rm (CO)=0.6\;\rm mol$, $n\rm (H_{2})=0.2\;\rm mol$,$n\rm (H_{2}O)=0.2\;\rm mol$,${n\rm (CO)}:n\rm (H_{2}O)=3:1$,体系中各气体的物质的量之和为$\rm 2.4\;\rm mol$,故${K_\rm p}=\dfrac{{{{p}}^{{2}}}{\rm (CO)}\cdot {{{p}}^{{2}}}{(}{{\rm {H}}_{{2}}}{)}}{{p\rm (C}{{\rm {H}}_{4}}{)}\cdot {p\rm (C}{{\rm {O}}_{{2}}}{)}}=\dfrac{{{\left( \dfrac{{0}{.6p}}{{2}{.4}} \right)}^{{2}}}\cdot {{\left( \dfrac{{0}{.2p}}{{2}{.4}} \right)}^{{2}}}}{\left( \dfrac{{0}{.8p}}{{2}{.4}} \right)\cdot \left( \dfrac{{0}{.6p}}{{2}{.4}} \right)}$;
二氧化碳电还原反应提供了一种生产乙醇的方法,已知反应过程中在三种不同催化剂表面$(\text{Cu}\text{C}/\text{Cu}\text{N}-\text{C}/\text{Cu})$的某个基元反应的能量变化如图所示$\rm (\text{IS}$表示始态,$\text{TS}$表示过渡态,$\text{FS}$表示终态,*表示催化剂活性中心原子$\rm )$。科学家研究发现铜表面涂覆一层氮掺杂的碳$(\text{N}-\text{C})$可以提高乙醇的选择性,其原因可能是 。
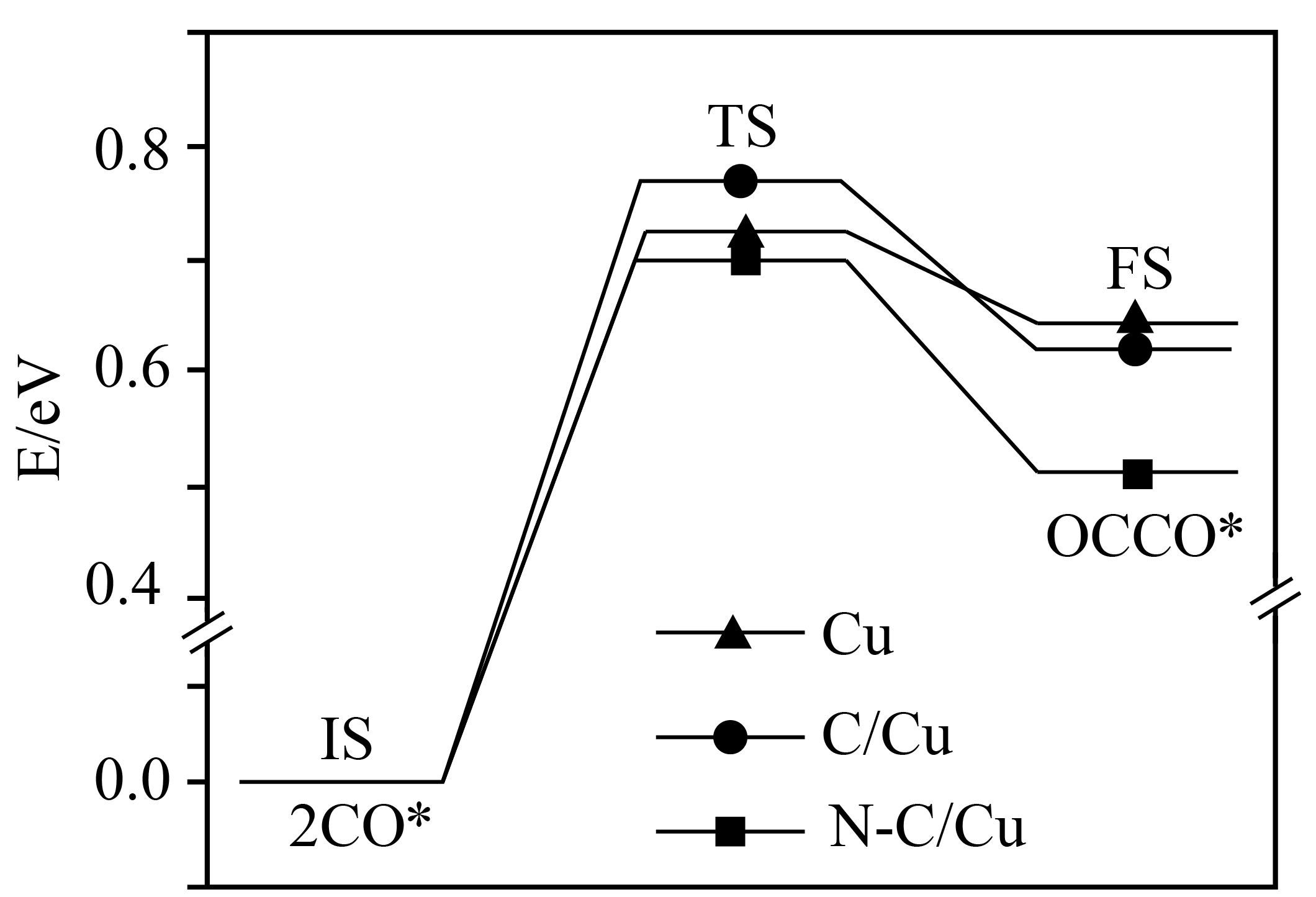
在$\\text{N}-\\text{C}/\\text{Cu}$催化剂表面,反应$2\\text{CO}*=\\text{OCCO}*$的活化能较小,促进了$\\text{C}-\\text{C}$键形成$\\rm ($或其他合理说法$\\rm )$
"]]催化剂可以降低反应的活化能,在$\rm N-C/Cu$催化剂表面,反应$\rm 2CO$*$\rm =OCCO$*的活化能较小,促进了$\rm C-C$键形成;
高中 | 化学平衡常数题目答案及解析(完整版)
