高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醛法测定$\text{NH}_{4}^{+}$的反应原理为$4\text{NH}_{4}^{+}+6\text{HCHO}={{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}}+3{{\text{H}}^{+}}+6{{\text{H}}_{2}}\text{O}$。取含$\text{N}{{\text{H}}_{4}}\text{Cl}$的废水浓缩至原体积的$\dfrac{1}{10}$后,移取$\rm 20.00\;\rm mL$,加入足量甲醛反应后,用$0.01000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$的$\rm NaOH$标准溶液滴定。滴定曲线如图$\rm 1$,含氮微粒的分布分数$\delta$与$\rm pH$关系如图$\rm 2[$比如:$\delta\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]=\dfrac{{c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]}{{c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]+{c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}} \right]}\rm ]$。下列说法正确的是$(\qquad)$
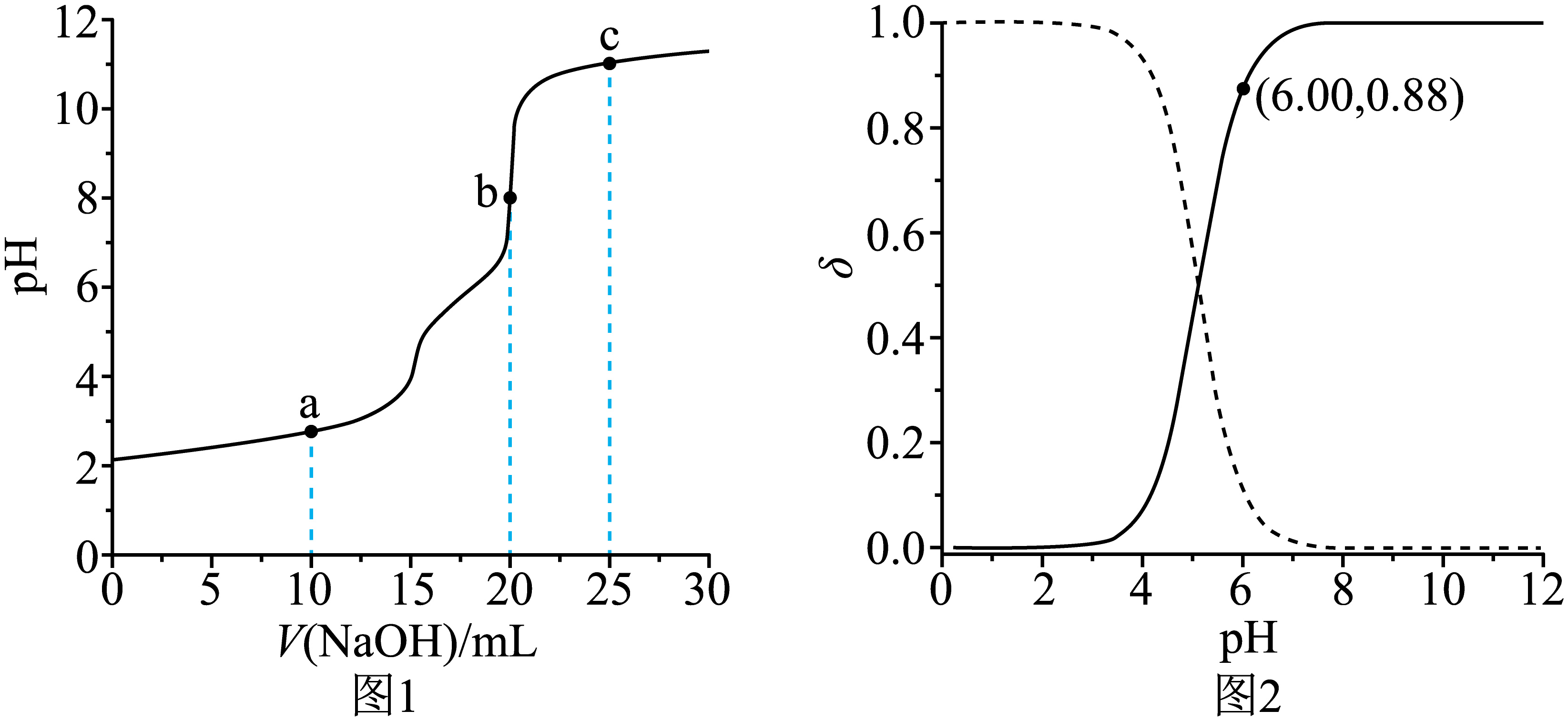
废水中$\\text{NH}_{4}^{+}$的含量为$20.00\\ \\text{mg}\\cdot {{\\text{L}}^{-1}}$
","$\\rm c$点:${c}\\left[ {{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{6}}{{\\text{N}}_{4}}{{\\text{H}}^{+}} \\right]+{c}\\left( {{\\text{H}}^{+}} \\right)={c}\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","$\\rm a$点:${c}\\left[ {{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{6}}{{\\text{N}}_{4}}{{\\text{H}}^{+}} \\right]\\gt {c}\\left( {{\\text{H}}^{+}} \\right)\\gt {c}\\left( \\text{O}{{\\text{H}}^{-}} \\right)\\gt {c}\\left[ {{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{6}}{{\\text{N}}_{4}} \\right]$
","${{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{6}}{{\\text{N}}_{4}}{{\\text{H}}^{+}}\\rightleftharpoons {{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{6}}{{\\text{N}}_{4}}+{{\\text{H}}^{+}}$的平衡常数${K}\\approx 7.3\\times {{10}^{-6}}$
"]$\rm A$.由图$\rm 1$中的信息可知,当加入$\rm NaOH$标准溶液的体积为$\rm 20.00\;\rm mL$时到达滴定终点,由关系式$\text{NH}_{4}^{+}$~$\rm [{{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}}+3{{\text{H}}^{+}}\rm ]$~$\rm 4\text{O}{{\text{H}}^{-}}$可知,由于待测液的体积和标准溶液的体积相同,因此,浓缩后的$\rm 20.00\;\rm mL$溶液中${c(\rm NH}_{4}^{+}\text{)=}4{c(\text O}{{\text{H}}^{-}}\text{)=}4\times 0.01000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}=0.04000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,则原废水中${c(\rm NH}_{4}^{+}{)=}0.04000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\times \dfrac{1}{10}=0.004000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,因此,废水中$\text{NH}_{4}^{+}$的含量为$0.004000\;\rm \text{mol}\times {18000\;\rm mg}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{L}}^{-1}}=72.00\ \text{mg}\cdot {{\text{L}}^{-1}}$,$\rm A$错误;
$\rm B$.$\rm c$ 点加入$\rm NaOH$标准溶液的体积过量,且只过量了$\dfrac{1}{5}$,由电荷守恒可知, ${c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]+{c}\left( {{\text{H}}^{+}} \right)+{c}\left( \text{N}{{\text{a}}^{+}} \right)={c}\left( \text{O}{{\text{H}}^{-}} \right)+{c}\left( \text{C}{{\text{l}}^{-}} \right)$,浓缩后的废水中$\text{N}{{\text{H}}_{4}}\text{Cl}$的浓度是$\rm NaOH$标准溶液浓度的$\rm 4$倍,$\text{C}{{\text{l}}^{-}}$和$\text{N}{{\text{a}}^{+}}$均不参与离子反应,可以估算$\rm c$点${c}\left( \text{C}{{\text{l}}^{-}} \right)\gt {c}\left( \text{N}{{\text{a}}^{+}} \right)$,${c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]+{c}\left( {{\text{H}}^{+}} \right)\gt {c}\left( \text{O}{{\text{H}}^{-}} \right)$,$\rm B$错误;
$\rm C$.${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}}$在溶液中水解使溶液显酸性,类比$\text{NH}_{3}^{{}}$可知${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}$在溶液中与水作用发生电离而使溶液显碱性;$\rm a$ 点为半滴定点,由其纵坐标可知溶液显酸性,说明${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}}$的水解作用强于${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}$的电离作用,可知溶液中相关粒子的浓度的大小关系为 ${c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}} \right]\gt {c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]$,$\rm C$错误;
$\rm D$.由图$\rm 1$和图$\rm 2$可知,当$\text{pH=6}\text{.00}$时,${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}$占比较高,$\delta\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}^{{}} \right]=0.88$,则由氮守恒可知,$\delta\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]=0.12$,两种粒子的浓度之比等于其分布分数之比,则${{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}}\rightleftharpoons {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}+{{\text{H}}^{+}}$的平衡常数 $K=\dfrac{{c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}} \right]\cdot {c(}{{\text{H}}^{+}}\text{)}}{{c}\left[ {{\left( \text{C}{{\text{H}}_{2}} \right)}_{6}}{{\text{N}}_{4}}{{\text{H}}^{+}} \right]}=\dfrac{0.88\times {{10}^{-6}}}{0.12}\approx 7.3\times {{10}^{-6}}$,$\rm D$正确;
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
