高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm 2024$年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦碳及其化合物的综合利用问题。回答下列问题:
Ⅰ.$\text{C}{{\text{O}}_{2}}$是典型的温室气体,$\rm Sabatier$反应可实现$\text{C}{{\text{O}}_{2}}$转化为甲烷,实现$\text{C}{{\text{O}}_{2}}$的资源化利用。
甲烷化反应:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H$。
$\rm Sabatier$反应所需的$\text{C}{{\text{O}}_{2}}$可从工业尾气中捕获,下列能作为捕获剂的是 $\rm ($填字母$\rm )$。
$\rm A$.氯化钙溶液 $\rm B$.小苏打溶液 $\rm C$.纯碱溶液 $\rm D$.硫酸铵溶液
$\\rm C$
"]]$\rm Sabatier$反应所需的$\rm CO_{2}$可从工业尾气中捕获,即能够吸收$\rm CO_{2}$的试剂,已知$\rm CaCl_{2}$溶液、小苏打即$\rm NaHCO_{3}$溶液、硫酸铵溶液均不能与$\rm CO_{2}$反应,不能能作为捕获剂,而纯碱即$\rm Na_{2}CO_{3}$溶液能够与$\rm CO_{2}$反应,$\rm Na_{2}CO_{3}+CO_{2}+H_{2}O=2NaHCO_{3}$,能够作为捕获剂。
已知:${{\text{H}}_{2}}$、$\text{C}{{\text{H}}_{4}}$的燃烧热$\Delta H$分别为$-285\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$、$-890\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,$1\text{ mol }{{\text{H}}_{2}}\text{O(l)}$转化为${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$吸收$44\text{ kJ}$的热量。甲烷化反应的$\Delta H=$ ,该反应在 $\rm ($填“高温”“低温”或“任何温度”$\rm )$下能自发进行。
$\\rm -162$ $\\rm kJ/mol$ ; 低温
"]]已知:${{\text{H}}_{2}}$、$\text{C}{{\text{H}}_{4}}$的燃烧热$\Delta H$分别为$-285\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$、$-890\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,$1\text{ mol }{{\text{H}}_{2}}\text{O(1)}$转化为${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$吸收$44\text{ kJ}$的热量,即
有反应$\rm i$:$\text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{\text{1}}}=-570\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,
反应$\rm ii$:$\text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right)\text{+2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{\text{2}}}=-890\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,
反应$\rm iii$:${{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{\text{3}}}=+44\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,
甲烷化反应$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$可由$\rm 2i-ii+2iii$得到,根据盖斯定律可知,$\Delta H=2\Delta {{H}_{1}}-\Delta {{H}_{2}}+2\Delta {{H}_{3}}=2\times \left( -570\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)-\left( -890\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)+2\times 44\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=-162\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,该反应是一个焓减的熵减反应,故在低温下能自发进行;
若$\rm 250$ $\rm ^\circ\rm C$下,恒压密闭容器中充入一定量$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$和${{\text{H}}_{2}}\left( \text{g} \right)$,下列条件不能说明反应达到平衡状态的是 $\rm ($填字母$\rm )$。
$\rm A$.混合气体的密度保持不变
$\rm B$.混合气体的平均相对分子质量保持不变
$\rm C$.容器的体积不变
$\rm D$.$n\left( {{\text{H}}_{2}}\text{O} \right)$和$n\left( \text{C}{{\text{H}}_{4}} \right)$的比值保持不变
$\\rm D$
"]]$\rm A$.由题干信息可知,反应过程中气体的质量不变,体积发生改变,即混合气体的密度始终在变,故混合气体的密度保持不变说明反应达到化学平衡,$\rm A$不合题意;
$\rm B$.已知同温同压下,气体的密度之比等于其相对分子质量之比,结合$\rm A$项分析可知,混合气体的平均相对分子质量保持不变说明反应达到化学平衡,$\rm B$不合题意;
$\rm C$.恒压下气体的体积与其物质的量呈正比,即反应过程中气体的体积始终在改变,故容器的体积不变说明反应达到化学平衡,$\rm C$不合题意;
$\rm D$.根据反应方程式可知,反应过程中$n\left( {{\text{H}}_{2}}\text{O} \right)$和$n\left( \text{C}{{\text{H}}_{4}} \right)$的比值始终为$\rm 2:1$,故$n\left( {{\text{H}}_{2}}\text{O} \right)$和$n\left( \text{C}{{\text{H}}_{4}} \right)$的比值保持不变不能说明反应达到化学平衡,$\rm D$符合题意;
Ⅱ.先进的甲醇低压羰基合成乙酸工艺的普及推广,导致我国乙酸产能过剩。在催化剂的作用下,乙酸和氢气反应的反应体系中有如下反应:
反应$\rm i$.$\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-44.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
反应$\rm ii$.$\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)+{{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-18.4\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
反应$\rm iii$.$\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{3}}=+24.5\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
现在$200\text{ kPa}$反应条件下,将$n\left( {{\text{H}}_{2}} \right):n\left( \text{C}{{\text{H}}_{3}}\text{COOH} \right)=10:1$的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性$S$随温度变化如下图所示。
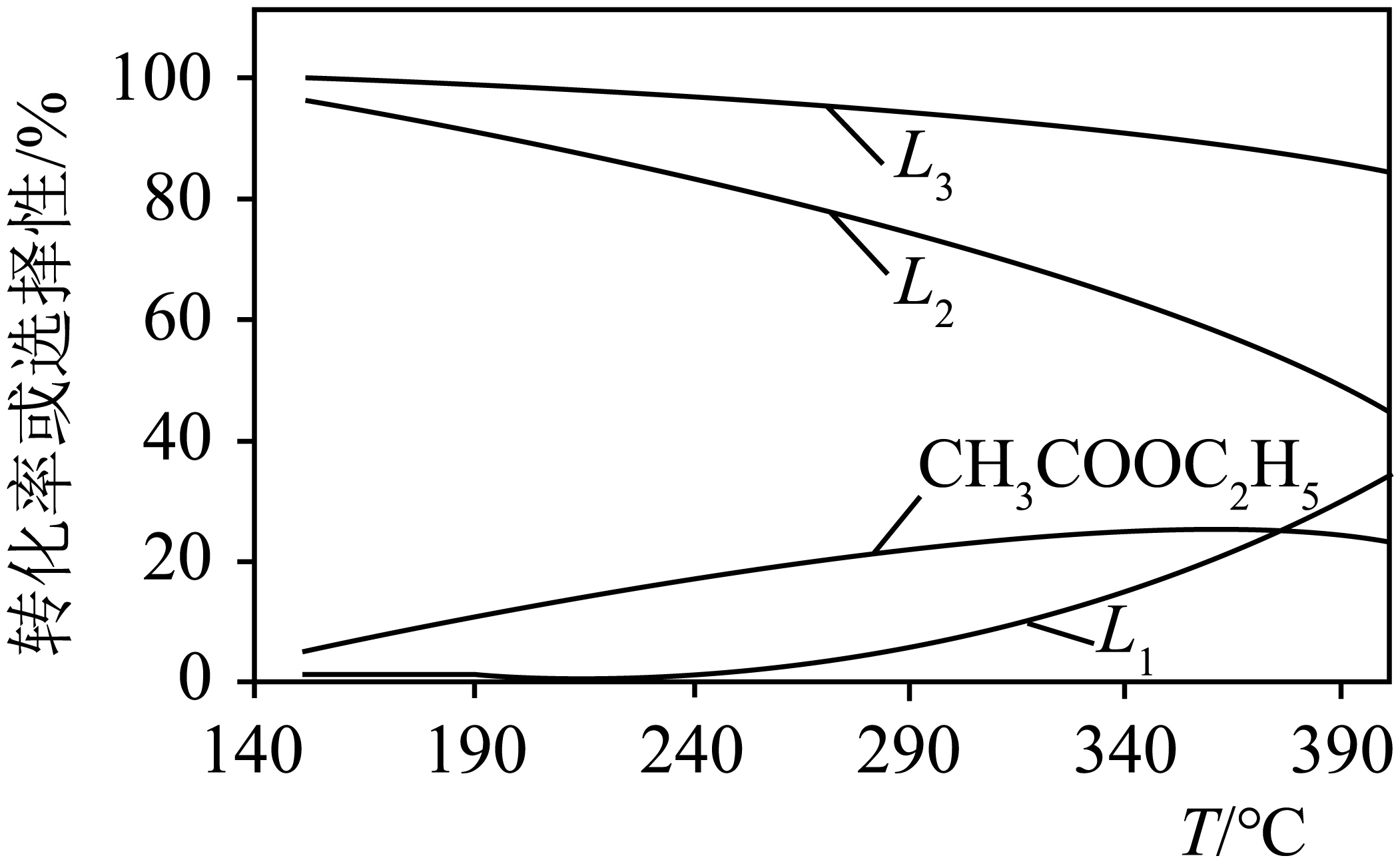
已知,$S\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)=\dfrac{2n\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)}{n\left( \text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH} \right)+2n\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)+n\left( \text{C}{{\text{H}}_{3}}\text{CHO} \right)}$。
①图中表示乙酸的转化率随温度变化的曲线是 。
②${{\text{H}}_{2}}$和$\text{C}{{\text{H}}_{3}}\text{COOH}$反应一段时间后,不改变反应时间和温度,能提高$S\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)$的可能措施是 $\rm ($任写一条$\rm )$。
③恒温恒压条件下,向初始体积为$1\text{L}$的体积可变密闭容器中通入$2\text{ mol }{{\text{H}}_{2}}$和$1\text{ mol C}{{\text{H}}_{3}}\text{COOH}$,发生上述反应,达到平衡时容器的体积变为$0.8\text{L}$,$\text{S}\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)=S\left( \text{C}{{\text{H}}_{3}}\text{CHO} \right)$,$n\left( {{\text{H}}_{2}} \right)=0.7\text{ mol}$。反应Ⅱ的平衡常数$K=$ $\rm ($保留$\rm 2$位小数$\rm )$。
${{\\text{L}}_{3}}$ ; 增大压强,或选择合适的催化剂$\\rm ($或分离产物$\\rm )$ ; $\\rm 0.27$
"]]①反应Ⅰ为放热反应,升高温度,平衡逆向移动,$\rm C_{2}H_{5}OH$的转化率下降,反应Ⅲ为吸热反应,升高温度,平衡逆向移动,$\rm CH_{3}CHO$的转化率上升,即$\rm L_{1}$为$\rm CH_{3}CHO$的选择性,由于$\rm CH_{3}CHO$、$\rm C_{2}H_{5}OH$、$\rm CH_{3}COOC_{2}H_{5}$的选择性相加为$\rm 1$,即$\rm L_{2}$为$\rm C_{2}H_{5}OH$的选择性,综上$\rm L_{3}$为乙酸的转化率随温度变化的曲线;
②反应Ⅱ、Ⅲ均为气体分子数相等的反应,即压强的变化对平衡移动无影响,Ⅰ为气体分子数减小的反应,增大压强,平衡正向移动,$S\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH} \right)$增大,选择合适的催化剂也能增大$S\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH} \right)$;
③达到平衡时容器的体积变为$\rm 0.8$ $\rm L$,反应Ⅱ、Ⅲ均为气体分子数相等的反应,Ⅰ为气体分子数减小的反应,即参与反应Ⅰ的$\rm H_{2}$的体积为$\rm (1\;\rm L-0.8$ $\rm L)\times 2=0.4$ $\rm L$,初始时$\rm 3\;\rm mol$气体对应体积为$\rm 1\;\rm L$,即$\rm 0.4\;\rm L$气体,对应物质的量为$\rm 1.2\;\rm mol$,即参与反应Ⅰ的$\rm H_{2}$的物质的量为$\rm 1.2\;\rm mol$,可得:$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{3}}}\text{COOH}(\text{g}) & \text{+2}{{\text{H}}_{\text{2}}}(\text{g}) & \rightleftharpoons \\起始量 \text{(mol)} & {} & {} & {} \\转化量 \text{(mol)} & \text{0}\text{.6} & \text{1}\text{.2} & {} \\ 平衡量\text{(mol)} & {} & {} & {} \\ \end{matrix}\begin{matrix} {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}(\text{g}) \\ {} \\ \text{0}\text{.6} \\ {} \\ \end{matrix}\begin{matrix} +{{\text{H}}_{\text{2}}}\text{O}(\text{g}) \\ {} \\ \text{0}\text{.6} \\ {} \\ \end{matrix}$,即反应Ⅲ参加反应的$\rm H_{2}$物质的量为$\rm 2\;\rm mol-1.2\;\rm mol-0.7\;\rm mol=0.1\;\rm mol$,可得:$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{3}}}\text{COOH(g)} & +{{\text{H}}_{\text{2}}}\text{(g)} & \rightleftharpoons \\起始量 \text{(mol)} & {} & {} & {} \\ 转化量\text{(mol)} & \text{0}\text{.1} & \text{0}\text{.1} & {} \\平衡量 \text{(mol)} & {} & {} & {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{3}}}\text{CHO(g)} \\ {} \\ \text{0}\text{.1} \\ {} \\ \end{matrix}\begin{matrix} +{{\text{H}}_{\text{2}}}\text{O(g)} \\ {} \\ \text{0}\text{.1} \\ {} \\ \end{matrix}$,$S\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)=\dfrac{2n\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)}{n\left( \text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH} \right)+2n\left( \text{C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}} \right)+n\left( \text{C}{{\text{H}}_{3}}\text{CHO} \right)}$,$n\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}} \right)=\dfrac{1}{2}n\left( \text{C}{{\text{H}}_{\text{3}}}\text{CHO} \right)=0.05\text{ mol}$,可知:$\begin{matrix} {} & \text{C}{{\text{H}}_{\text{3}}}\text{COOH(g)} & \text{+C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(g)} & \rightleftharpoons \\起始量 \text{(mol)} & {} & {} & {} \\转化量 \text{(mol)} & \text{0}\text{.05} & \text{0}\text{.05} & {} \\平衡量 \text{(mol)} & {} & {} & {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{3}}}\text{COOC}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{3}}}\text{(g)} \\ {} \\ \text{0}\text{.05} \\ {} \\ \end{matrix}\begin{matrix} +{{\text{H}}_{\text{2}}}\text{O(g)} \\ {} \\ \text{0}\text{.05} \\ {} \\ \end{matrix}$,即$n\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)\rm =1\;\rm mol-0.6\;\rm mol-0.1\;\rm mol-0.05\;\rm mol=0.25\;\rm mol$、$n\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH} \right)\rm =0.6\;\rm mol-0.05\;\rm mol=5.5\;\rm mol$、$n\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}} \right)\rm =0.05\;\rm mol$、$n\left( {{\text{H}}_{\text{2}}}\text{O} \right)\rm =0.6\;\rm mol+0.1\;\rm mol+0.05\;\rm mol=0.75\;\rm mol$,反应Ⅱ的平衡常数$K=\dfrac{c\text{(C}{{\text{H}}_{\text{3}}}\text{COOC}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{3}}}\text{)}c\text{(}{{\text{H}}_{\text{2}}}\text{O)}}{c\text{(C}{{\text{H}}_{\text{3}}}\text{COOH)}c\text{(C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH)}}\rm =\dfrac{\dfrac{\text{0}\text{.05 mol}}{\text{0}\text{.8 L}}\times\dfrac{\text{0}\text{.75 mol}}{\text{0}\text{.8 L}}}{\dfrac{\text{0}\text{.25 mol}}{\text{0}\text{.8 L}}\times\dfrac{\text{0}\text{.55 mol}}{\text{0}\text{.8 L}}}\rm =\dfrac{3}{11}\approx 0.27$。
高中 | 化学平衡常数题目答案及解析(完整版)
