高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{N}{{\text{O}}_{x}}$和$\text{S}{{\text{O}}_{x}}$是工业生产中常见污染物,深入理解大气中$\text{N}{{\text{O}}_{x}}$和$\text{S}{{\text{O}}_{x}}$等转化机制和相互作用规律,可以建立更准确的大气化学模型,为制定有效的环境保护政策和措施提供科学依据。其中涉及的主要反应如下:
Ⅰ.$2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{1}}=-114.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
Ⅱ.$\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{S}{{\text{O}}_{3}}\left( \text{g} \right)+\text{NO}\left( \text{g} \right)\qquad\Delta{{H}_{2}}=-41.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
回答下列问题:
在标准状态下,由指定单质生成$1\;\rm \text{mol}$纯化合物时的反应焓变称为该化合物的标准摩尔生成焓$\left( {{\Delta}_{\text{f}}}{{H}^{\theta }} \right)$。下列几种物质的标准摩尔生成焓$\left( {{\text{ }\!\!\Delta}_{\text{f}}}{{H}^{\theta }} \right)$如表所示:
| 物质 | $\text{N}{{\text{O}}_{2}}\left( \text{g} \right)$ | $\text{S}{{\text{O}}_{2}}\left( \text{g} \right)$ | $\text{S}{{\text{O}}_{3}}\left( \text{g} \right)$ | $\text{NO}\left( \text{g} \right)$ |
| 标准摩尔生成焓$\left( {{\Delta}_{\text{f}}}{{H}^{\theta }} \right)/\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ | $\rm +33.2$ | $a$ | $\rm -395.7$ | $\rm +90.3$ |
则$\text{S}{{\text{O}}_{2}}\left( \text{g} \right)$的标准摩尔生成焓${{\Delta}_{\text{f}}}{{H}^{\theta }}=$ 。
$\\rm -296.8\\;\\rm kJ/mol$
"]]反应的焓变等于总生成物的标准摩尔生成焓之和减去总反应物的标准摩尔生成焓之和,即$\Delta{{H}_{2}}={{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{NO} \right)+{{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{S}{{\text{O}}_{3}} \right)-{{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{N}{{\text{O}}_{2}} \right)-{{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{S}{{\text{O}}_{2}} \right)$,则${-41.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}}={+90.3\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}+\left( -395.7\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)}-{33.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}}-{{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{S}{{\text{O}}_{2}} \right)$,解得${{\Delta}_{\text{f}}}{{H}^{\theta }}\left( \text{S}{{\text{O}}_{2}} \right)=-296.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
在$\rm 250\;\rm ^\circ\rm C$条件下,在恒容密闭容器中充入$2\text{ mol NO}$、$2\text{ mol S}{{\text{O}}_{2}}$和$1\;\rm \text{mol }{{\text{O}}_{2}}$,发生上述反应,下列情况不能表明反应达到平衡状态的是$(\quad\ \ \ \ )\rm ($填字母$\rm )$。
${{v}_正{}}\\left( \\text{S}{{\\text{O}}_{2}} \\right)={{v}_逆{}}\\left( \\text{S}{{\\text{O}}_{3}} \\right)$
","$\\text{S}{{\\text{O}}_{3}}\\left( \\text{g} \\right)$和$\\text{NO}\\left( \\text{g} \\right)$的分压之比为$p\\left( \\text{S}{{\\text{O}}_{3}} \\right):p\\left( \\text{NO} \\right)=1:1$
","混合气体密度不随时间变化
","气体平均摩尔质量不随时间变化
"]$\rm A$.反应Ⅰ不涉及$\text{S}{{\text{O}}_{2}}$与$\text{S}{{\text{O}}_{3}}$,反应Ⅱ中$\text{S}{{\text{O}}_{2}}$与$\text{S}{{\text{O}}_{3}}$的化学计量数之比为$1:1$,则${{v}_正{}}\left( \text{S}{{\text{O}}_{2}} \right)={{v}_逆{}}\left( \text{S}{{\text{O}}_{3}} \right)$时,说明反应Ⅱ达到平衡,且此时反应Ⅰ也需达到平衡,故$\rm A$错误;
$\rm B$.$\text{S}{{\text{O}}_{3}}\left( \text{g} \right)$和$\text{NO}\left( \text{g} \right)$的分压之比为$1:1$时,不能说明反应达到平衡,故$\rm B$正确;
$\rm C$.该反应Ⅰ与反应Ⅱ涉及的物质均为气体且为恒容容器,反应过程中混合气体密度不随时间变化,不能说明反应达到平衡,故$\rm C$正确;
$\rm D$.反应Ⅰ为气体分子数目减少的反应,气体平均摩尔质量不随时间变化,则说明反应Ⅰ达到平衡,此时若反应Ⅱ未达到平衡,会破坏反应Ⅰ的平衡状态,则气体平均摩尔质量不随时间变化时,可以说明反应达到平衡状态,故$\rm D$错误;
故答案为$\rm BC$。
在某温度下,将$0.2\text{ mol NO}$、$0.2\text{ mol S}{{\text{O}}_{2}}$和$0.1\;\rm \text{mol }{{\text{O}}_{2}}$通入某恒压密闭容器中发生上述反应,达到平衡时,$\text{S}{{\text{O}}_{2}}$、$\text{S}{{\text{O}}_{3}}$的物质的量和${{\text{O}}_{2}}$的转化率随压强变化曲线如图所示。
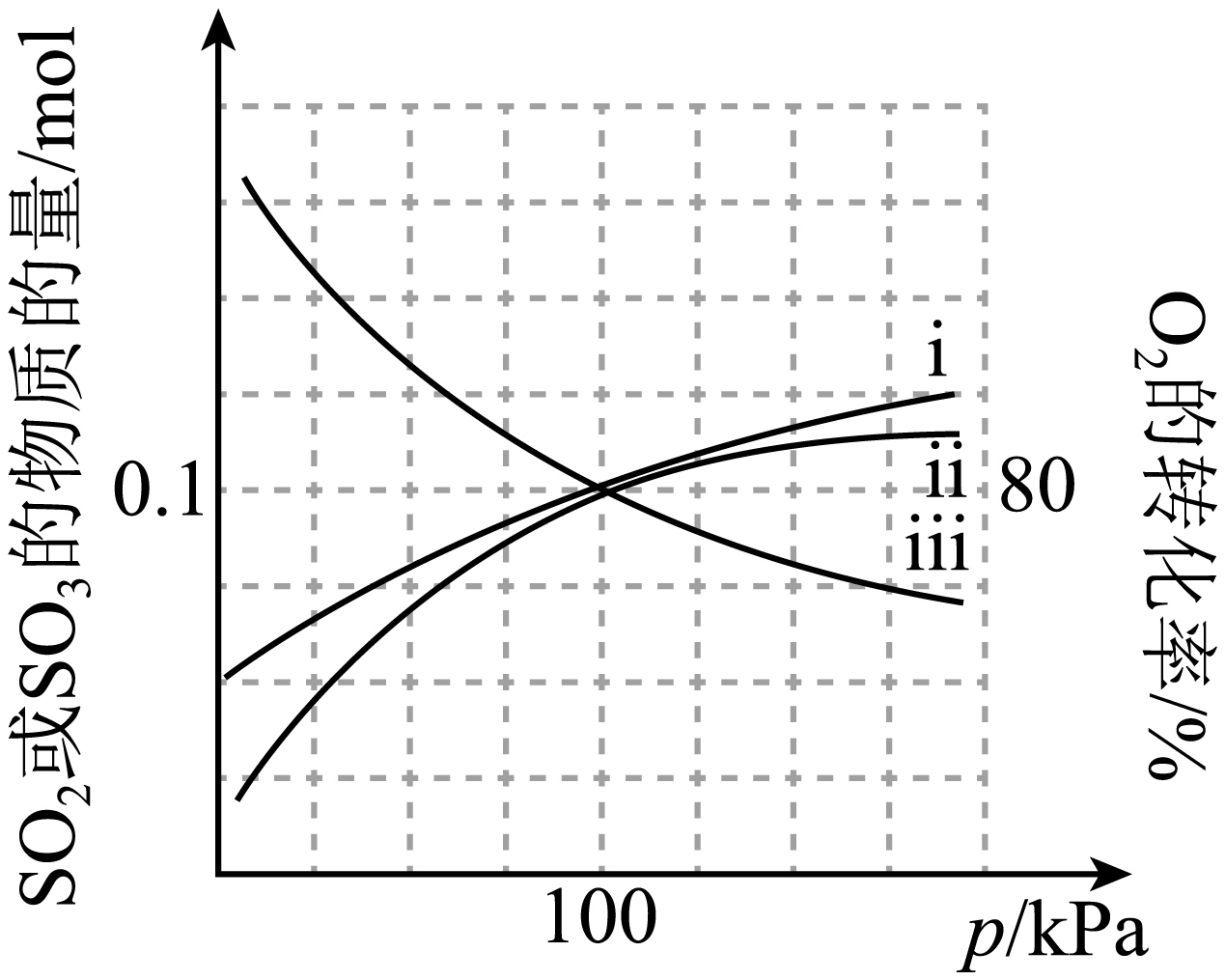
①曲线$\rm i$表示 随压强变化的曲线。
②欲提高$\text{S}{{\text{O}}_{2}}$的平衡转化率,可采取的措施为 $\rm ($任写一种$\rm )$。
③当压强为$100\;\rm \text{kPa}$时,若平衡时$\text{S}{{\text{O}}_{3}}$的体积分数为$\dfrac{5}{21}$,则$\text{NO}$的转化率为 ,反应Ⅱ的平衡常数${{K}_{\text{p}}}$为 $\rm ($保留三位有效数字$\rm )$。
$\\text{S}{{\\text{O}}_{3}}$的物质的量;加压$\\rm ($或分离出三氧化硫、降温、增大$\\text{N}{{\\text{O}}_{2}}$的分压任答一种即可$\\rm )$;$\\rm 30\\%$;$\\rm 2.33$
"]]①反应Ⅰ为气体分子数目减少的反应,压强增大,平衡正向移动,反应Ⅱ为分子数目相等的反应,本身平衡不受压强影响,但压强增大反应Ⅰ平衡正向移动,$\text{N}{{\text{O}}_{2}}$增多,故随压强增大,${{\text{O}}_{2}}$的转化率增大,$\text{S}{{\text{O}}_{3}}$的物质的量增加,$\text{S}{{\text{O}}_{2}}$的物质的量减少,且$\text{S}{{\text{O}}_{3}}$增加的量与$\text{S}{{\text{O}}_{2}}$减少的量相等,则曲线$\rm i$代表$\text{S}{{\text{O}}_{3}}$的物质的量随压强变化的曲线;
②反应Ⅱ的$\Delta{{H}_{2}}\lt 0$,温度降低平衡正向移动,且由前面可知,则加压、分离出三氧化硫、增大$\text{N}{{\text{O}}_{2}}$的分压也可提高$\text{S}{{\text{O}}_{2}}$的平衡转化率;
③当压强为$100\;\rm \text{kPa}$时,由图可知,$\text{S}{{\text{O}}_{2}}$、$\text{S}{{\text{O}}_{3}}$的物质的量$n\left( \text{S}{{\text{O}}_{2}} \right)=n\left( \text{S}{{\text{O}}_{3}} \right)=0.1\;\rm \text{mol}$,则平衡时体系总物质的量为$0.1\;\rm \text{mol}\div \dfrac{5}{21}=0.42\;\rm \text{mol}$,由反应$\text{I}$化学计量数可知,气体减少量为${{\text{O}}_{2}}$反应的量,则反应掉$0.08\;\rm \text{mol}{{\text{O}}_{2}}$,根据三段式:
$\begin{array}{*{35}{l}} {} & 2\text{NO}\left( \text{g} \right)+ & {{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons & 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right) \\反应前 \left( \text{mol} \right) & 0.2 & 0.1 & 0 \\反应量 \left( \text{mol} \right) & 0.16 & 0.08 & 0.16 \\反应后 \left( \text{mol} \right) & 0.04 & 0.02 & 0.16 \\ \end{array}$
$\begin{array}{*{35}{l}} {} & \text{S}{{\text{O}}_{2}}\left( \text{g} \right)+ & \text{N}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons & \text{S}{{\text{O}}_{3}}\left( \text{g} \right)+ & \text{NO}\left( \text{g} \right) \\ 反应前\left( \text{mol} \right) & 0.2 & 0.16 & 0 & 0.04 \\ 反应量\left( \text{mol} \right) & 0.1 & 0.1 & 0.1 & 0.1 \\反应后 \left( \text{mol} \right) & 0.1 & 0.06 & 0.1 & 0.14 \\ \end{array}$
则$\text{NO}$的转化率$=\dfrac{0.2\;\rm \text{mol}-0.14\;\rm \text{mol}}{0.2\;\rm \text{mol}}\times 100\%=30\%$,反应Ⅱ的平衡常数${{K}_{\text{p}}}=\dfrac{\dfrac{n\left( \text{S}{{\text{O}}_{3}} \right)}{{{n}_总{}}}p\times \dfrac{n\left( \text{NO} \right)}{{{n}_总{}}}p}{\dfrac{n\left( \text{S}{{\text{O}}_{2}} \right)}{{{n}_总{}}}p\times \dfrac{n\left( \text{N}{{\text{O}}_{2}} \right)}{{{n}_总{}}}p}=\dfrac{0.1\times 0.14}{0.1\times 0.06}\approx 2.33$。
反应Ⅱ平衡时的正、逆反应速率可分别表示为${{v}_正{}}={{k}_正{}}\cdot p\left( \text{N}{{\text{O}}_{2}} \right)\cdot p\left( \text{S}{{\text{O}}_{2}} \right)$、${{v}_逆{}}={{k}_逆{}}\cdot p\left( \text{NO} \right)\cdot p\left( \text{S}{{\text{O}}_{3}} \right) ({{k}_正{}}$、${{k}_逆{}}$分别为正、逆反应速率常数,$p$为物质的分压$\rm )$。
①反应达到平衡后,仅降低温度,下列说法正确的是 $\rm ($填字母$\rm )$。
$\rm A$.${{k}_正{}}$、${{k}_逆{}}$均增大,且${{k}_正{}}$增大的程度较大
$\rm B$.${{k}_正{}}$、${{k}_逆{}}$均减小,且${{k}_正{}}$减小的程度较小
$\rm C$.${{k}_正{}}$增大、${{k}_逆{}}$减小,平衡正向移动
$\rm D$.${{k}_正{}}$、${{k}_逆{}}$均减小,且${{k}_逆{}}$减小的程度较小
②若按$(3)$中的条件发生反应,该温度下${{k}_正{}}$与${{k}_逆{}}$的大小关系为:${{k}_正{}}$ ${{k}_逆{}} ($填“大于”“小于”或“等于”$\rm )$。
$\\rm B$;大于
"]]①反应Ⅰ和反应Ⅱ均为放热反应,反应达到平衡后,仅降低温度,平衡正向移动,${{k}_正{}}$、${{k}_逆{}}$均减小,且${{k}_正{}}$减小的程度较小;
②若按$(3)$中的条件发生反应,该温度下的平衡常数${{K}_{\text{p}}}=\dfrac{{{k}_正{}}}{{{k}_逆{}}}=2.33\gt 1$,因此${{k}_正{}}$大于${{k}_逆{}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
