高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙醇是一种绿色能源,一种用$\rm CO$和${{\text{H}}_{\text{2}}}$合成乙醇的反应原理如下:
主反应ⅰ。$\text{2CO}\left( \text{g} \right)+\text{4}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-256.4\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
副反应ⅱ。$\text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\rightleftharpoons {{\text{H}}_{\text{2}}}\left( \text{g} \right)+\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-41.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
副反应ⅲ。$\text{2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{6}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{3}}$
回答下列问题:
$\Delta {{H}_{3}}=$ 。
$-173.6\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]由盖斯定律可知$\Delta {{H}_{3}}=\Delta {{H}_{1}}-2\Delta {{H}_{2}}=-173.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
主反应ⅰ在 $\rm ($填“较高温度”“较低温度”或“任何温度”$\rm )$下有自发反应的趋势。
较低温度
"]]主反应ⅰ为熵减、放热反应,所以在较低温度下有自发反应的趋势。
某科研小组结合实验与计算机模拟结果,研究了在催化剂表面上发生副反应ⅲ的反应历程,如图所示,其中吸附在催化剂表面上的物种用“*”标注$\rm ($省略了部分未吸附在催化剂表面的物质$\rm )$。
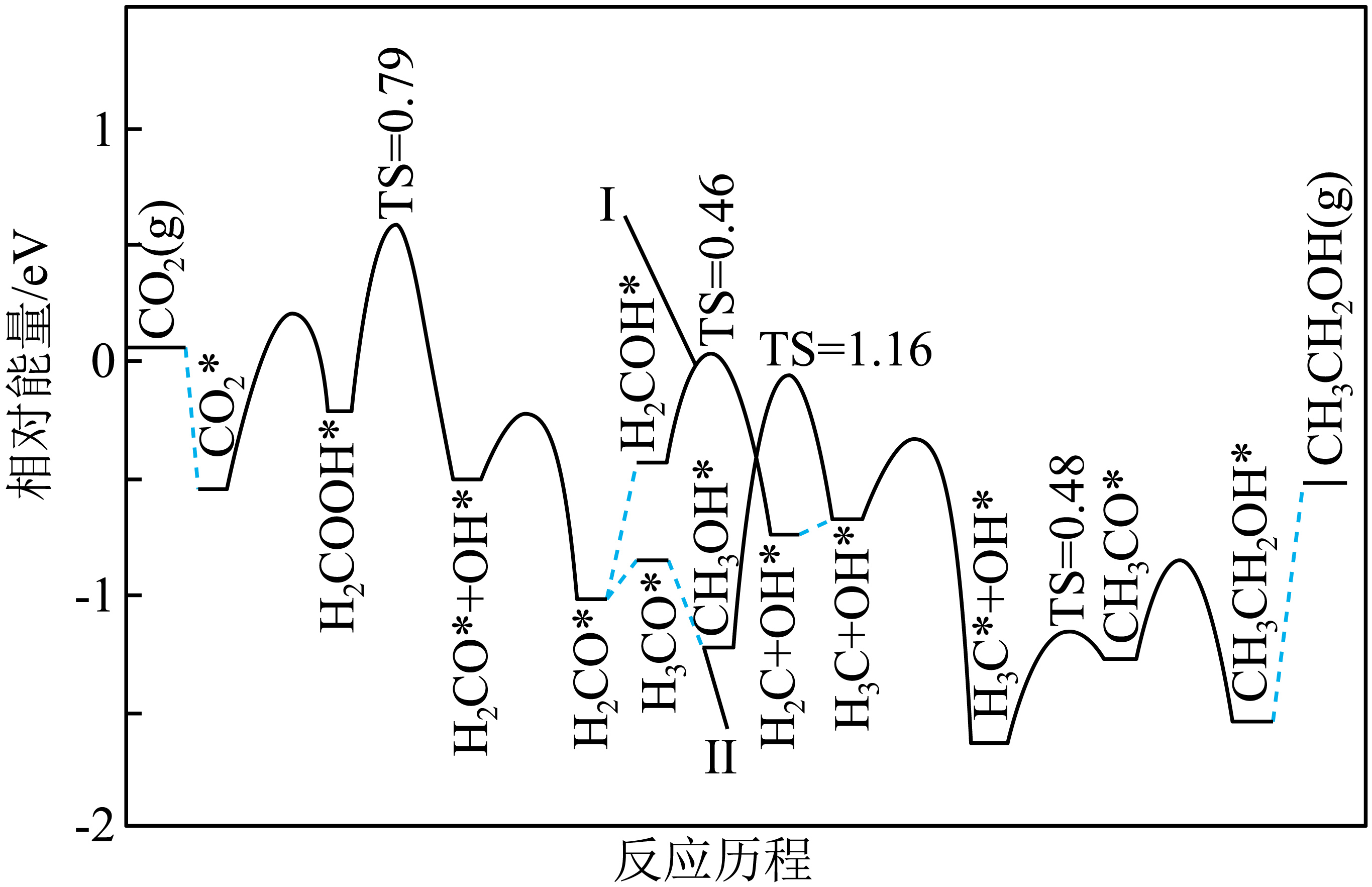
该催化的中间过程有两个反应路径,其中优势路径为 $\rm ($填“路径Ⅰ”或“路径Ⅱ”$\rm )$;劣势路径的决速步骤的化学方程式为 。
路径Ⅰ ; $\\text{C}{{\\text{H}}_{\\text{3}}}\\text{O}{{\\text{H}}^{*}}=\\text{C}{{\\text{H}}_{\\text{3}}}+\\text{O}{{\\text{H}}^{*}}$
"]]由题图可知,两个反应路径中的优势路径为路径Ⅰ,其活化能较低;路径Ⅱ的决速步骤的化学方程式为$\text{C}{{\text{H}}_{\text{3}}}\text{O}{{\text{H}}^{*}}=\text{C}{{\text{H}}_{\text{3}}}+\text{O}{{\text{H}}^{*}}$。
一定温度下,在某特定催化剂表面上只发生副反应ⅱ。已知:${{k}_{正}}$和${{k}_{逆}}$分别表示正、逆反应速率常数,且正反应速率${{v}_{正}}={{k}_{正}}\cdot {{c}^{0.5}}\left( \text{CO} \right)\cdot c\left( {{\text{H}}_{2}}\text{O} \right)$。若$K=\dfrac{{{k}_{正}}}{{{k}_{逆}}}$,则逆反应速率${{v}_{逆}}=$ ,升高温度后${{k}_{正}}$和${{k}_{逆}}$的变化量$\Delta {{k}_{正}}$ $\Delta {{k}_{逆}}\rm ($填“$\rm \gt $”“$\rm =$”或“$\rm \lt $”$\rm )$。
${{k}_{逆}}\\cdot {{c}^{-0.\\text{5}}}\\left( \\text{CO} \\right)\\cdot c\\left( {{\\text{H}}_{\\text{2}}} \\right)\\cdot c\\left( \\text{C}{{\\text{O}}_{\\text{2}}} \\right)$ ; $\\rm \\lt $
"]]根据化学平衡常数关系可知化学平衡常数$K=\dfrac{{{k}_{正}}}{{{k}_{逆}}}=\dfrac{c\left( {{\text{H}}_{\text{2}}} \right)\cdot c\left( \text{C}{{\text{O}}_{\text{2}}} \right)}{c\left( \text{CO} \right)\cdot c\left( {{\text{H}}_{\text{2}}}\text{O} \right)}$,得逆反应速率${{v}_{逆}}={{k}_{逆}}\cdot {{c}^{-0.\text{5}}}\left( \text{CO} \right)\cdot c\left( {{\text{H}}_{\text{2}}} \right)\cdot c\left( \text{C}{{\text{O}}_{\text{2}}} \right)$;该反应为放热反应,温度升高逆反应速率增大量大于正反应速率增大量,所以升高温度后${{k}_{正}}$和${{k}_{逆}}$的变化量$\Delta {{k}_{正}}\lt \Delta {{k}_{逆}}$。
向密闭容器中加入$0.2\,\text{mol}\,\text{CO}\left( \text{g} \right)$和$0.4\text{ mol}\,{{\text{H}}_{\text{2}}}\left( \text{g} \right)$发生反应ⅰ、ⅱ。$\rm CO$的平衡转化率分别随温度、压强变化关系如图,已知图中$\rm L$、$\rm X$可分别代表压强或温度。
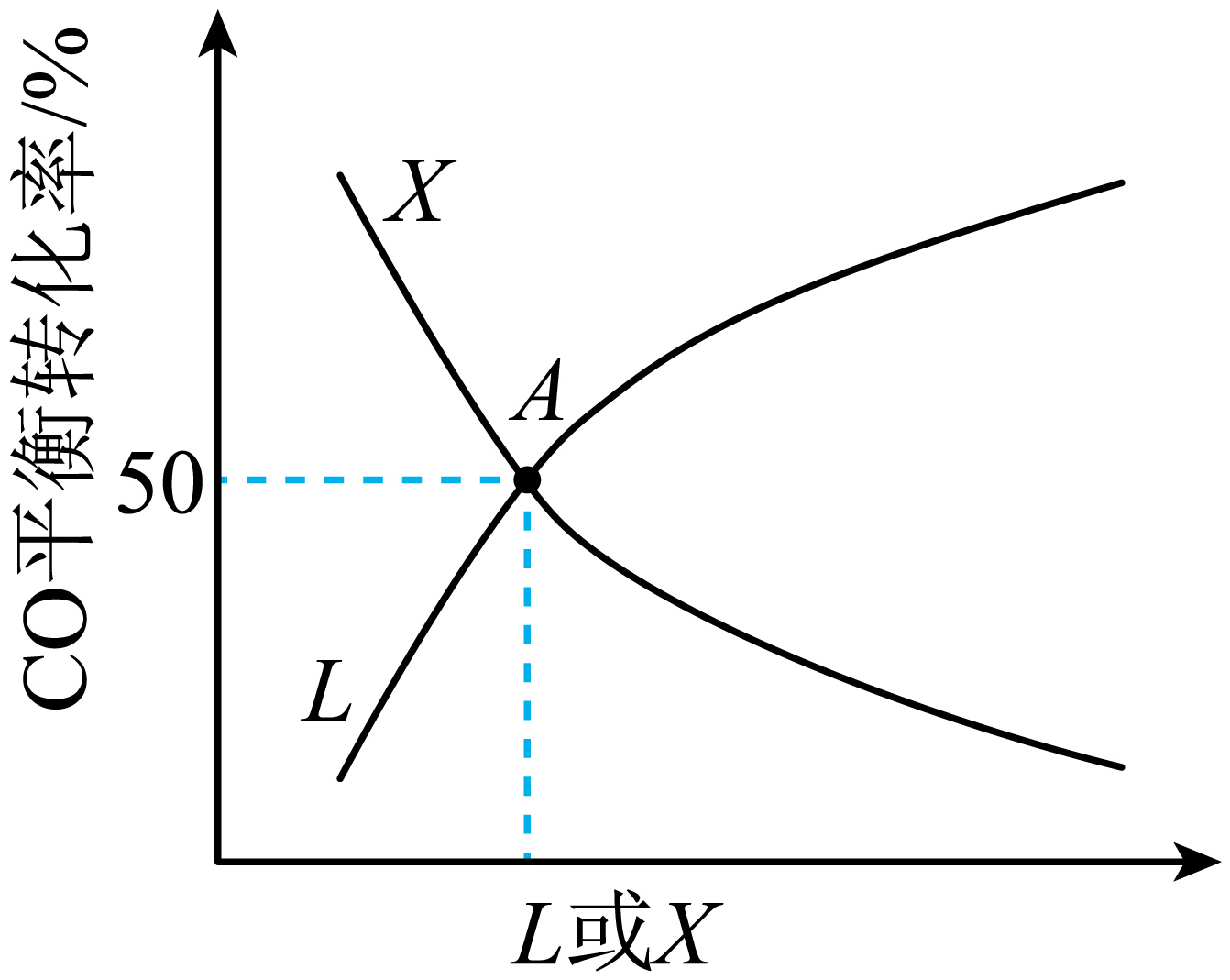
①$\rm X$代表的物理量是 $\rm ($填“温度”或“压强”$\rm )$,原因为 。
②已知在$\rm A$点条件下,上述反应达到平衡状态时$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$的物质的量为$\rm 0.02$ $\rm mol$,则${{\text{H}}_{\text{2}}}$的平衡转化率$\alpha =$ ;副反应ⅱ的平衡常数$K=$ 。
温度 ; 反应ⅰ和反应ⅱ均为放热反应,温度越高,$\\rm CO$的平衡转化率越低$\\rm ($或反应ⅰ为反应前后气体化学计量数之和减小的反应,反应ⅱ为反应前后气体化学计量数之和不变的反应,所以压强越大,$\\rm CO$的平衡转化率越高 ; $\\rm 35\\%$ ; $\\rm 2.6$
"]]①反应ⅰ和反应ⅱ均为放热反应,温度越高,$\rm CO$的平衡转化率越低,反应ⅰ为反应前后气体化学计量数之和减小的反应,反应ⅱ为反应前后气体化学计量数之和不变的反应,所以压强越大,$\rm CO$的平衡转化率越高,则$\rm X$代表的物理量是温度,$\rm L$代表的物理量是压强。
②$\rm A$点时$\rm CO$的平衡转化率为$\rm 50\%$,可列“三段式”:
$\begin{matrix}主反应{\rm ⅰ} . & \text{2CO}\left( \text{g} \right) & + & \text{4}{{\text{H}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\起始量 \text{/mol} & 0.2 & {} & 0.4 & {} & 0 & {} & 0 \\ 转化量\text{/mol} & 0.08 & {} & 0.16 & {} & 0.04 & {} & 0.04 \\平衡量 \text{/mol} & 0.12 & {} & 0.24 & {} & 0.04 & {} & 0.04 \\ \end{matrix}$
$\begin{matrix} 主反应{\rm ⅱ}. & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) & \rightleftharpoons & {{\text{H}}_{\text{2}}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) \\ 起始量\text{/mol} & 0.12 & {} & 0.04 & {} & 0.24 & {} & 0 \\ 转化量\text{/mol} & 0.02 & {} & 0.02 & {} & 0.02 & {} & 0.02 \\平衡量 \text{/mol} & 0.1 & {} & 0.02 & {} & 0.26 & {} & 0.02 \\ \end{matrix}$
最终体系中含有$0.1\text{ mol }\,\text{CO}\left( \text{g} \right)$, $0.26\text{ mol}\,\text{ }{{\text{H}}_{\text{2}}}\left( \text{g} \right)$, $0.04\,\text{mol }{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}\left( \text{g} \right)$, $0.02\,\text{mol}\,\text{ }{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$, $0.02\,\text{mol}\,\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$,所以${{\text{H}}_{\text{2}}}$的平衡转化率$\alpha =\dfrac{\left( 0.\text{4}-0.26 \right)\,\text{mol}}{0.\text{4}\,\text{mol}}\times 100\%=35\%$;由于副反应ⅱ反应前后气体化学计量数均为$\rm 1$,则化学平衡常数$K=\dfrac{0.26\times 0.02}{0.1\times 0.02}=2.6$。
高中 | 化学平衡常数题目答案及解析(完整版)
