高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲硫醇$\rm (C{{H}_{3}}SH)$是重要的有机化工中间体,可用于合成维生素。通过$\rm C{{H}_{3}}OH$和$\rm {{H}_{2}}S$合成$\rm C{{H}_{3}}SH$的主要反应如下:
反应Ⅰ:${\rm C{{H}_{3}}OH(g)+{{H}_{2}}S(g)\rightleftharpoons C{{H}_{3}}SH(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{1}}$
反应Ⅱ:${\rm 2C{{H}_{3}}OH(g)+{{H}_{2}}S(g)\rightleftharpoons C{{H}_{3}}SC{{H}_{3}}(g)+2{{H}_{2}}O(g)}\quad\Delta{{H}_{2}}=+a\ \rm kJ\cdot mo{{l}^{-1}}$
回答下列问题:
已知反应Ⅱ中相关的化学键的键能数据如下:
| 化学键 | $\rm C-H$ | $\rm C-O$ | $\rm H-O$ | $\rm S-H$ |
| 键能$\rm /(kJ\cdot mo{{l}^{-1}})$ | $b$ | $c$ | $ d$ | $e$ |
断开$\rm 1\ mol\ C-S$键需要吸收 $\rm \ kJ$的能量。
$(c+e-d-\\dfrac{a}{2})$
"]]反应物Ⅱ中断裂化学键,所需要的能量总和为:$3b\times 2+2c+2d+2e$,生成产物放出的能量总和是:$ 6b+2E(C-S)+4d$,根据$\Delta H=$ 断裂键所需总能量$-$形成键所放出总能量$=(6b+2c+2d+2e)-[6b+2E{\rm (C-S)}+4d]=a$,所以断开$\rm 1\ mol\ C-S$键需要吸收的能量是:$(c+e-d-\dfrac{a}{2})\ \rm kJ$。
甲醇的沸点$\rm (64.7\ ^\circ \text{C})$介于水$\rm ($沸点为$\rm 100\ ^\circ \text{C})$和甲硫醇$\rm ($沸点为$\rm 7.6\ ^\circ \text{C})$之间,其原因是 。
甲醇分子间可以形成氢键,但是其氢键的数目小于水,甲硫醇分子间没有氢键
"]]甲醇含有羟基,其分子间能够形成氢键,但是由于其形成的氢键数目小于水,甲硫醇分子间没有氢键,故其沸点居于两者之间。
下列有关$\rm C{{H}_{3}}OH$和$\rm {{H}_{2}}S$制取甲硫醇的说法正确的是 $\rm ($填字母$\rm )$。
$\rm A$.使用催化剂或升高温度都可以提高活化分子百分数,从而缩短达到化学平衡的时间
$\rm B$.一定温度下,向恒容密闭容器中充入一定量$\rm C{{H}_{3}}OH(g)$和$\rm {{H}_{2}}S(g)$,反应后,若容器内气体密度不再发生变化,则说明反应已达到化学平衡状态
$\rm C$.一定条件下,向恒容密闭容器中充入一定量$\rm C{{H}_{3}}OH(g)$和$\rm {{H}_{2}}S(g)$,反应达到平衡后,若按相同比例再充入一定量$\rm C{{H}_{3}}OH(g)$和$\rm {{H}_{2}}S(g)$,$\rm C{{H}_{3}}OH(g)$的平衡转化率不变
$\\rm AC$
"]]$\rm A$.升高温度或使用催化剂都可以提高活化分子百分数,从而加快反应速率,使平衡更快到达,缩短达到化学平衡的时间,$\rm A$正确。
$\rm B$.所有物质都呈气态,建立平衡的过程中,混合气体的总质量始终不变,在恒容容器中,气体的密度始终不变,因而“密度不再变化”并不能判定一定达到平衡状态,$\rm B$错误。
$\rm C$.若按相同比例再充入一定量$\rm C{{H}_{3}}OH(g)$和$\rm {{H}_{2}}S(g)$,相当于加压,两个反应都是气体分子数不变的反应,增大压强,平衡不移动,所以甲醇的平衡转化率不变,$\rm C$正确。
温度为${{T}_{1}}\ ^\circ \text{C}$,向压强为${{p}_{0}}$的恒压密闭容器中充入$\rm C{{H}_{3}}OH(g)$和$\rm {{H}_{2}}S(g)($物质的量之比为$\rm 1:2)$发生反应Ⅰ和Ⅱ,达到平衡时,$\rm C{{H}_{3}}OH(g)$的转化率为$\rm 80\%$,$\rm C{{H}_{3}}SC{{H}_{3}}(g)$的体积分数为$\rm 5\%$。
①$\rm {CH}_{3} {SH}({g})$的选择性为 $\rm (C{{H}_{3}}SH $的选择性$\rm =\dfrac{生成C{{H}_{3}}SH的物质的量}{消耗C{{H}_{3}}OH的总物质的量}\times 100 \%)$。②反应$\rm I$的平衡常数${{K}_{\rm p}}=$ $\rm ($保留$\rm 3$位有效数字,${{K}_{\rm p}}$是用分压表示的平衡常数$\rm )$。
$\\rm 62.5\\%$;$\\rm 1.48$
"]]①假设通入$\rm 1\ mol\ C{{H}_{3}}OH( g)$、$\rm 2\ mol\ {{H}_{2}}S(g)$,达到平衡时,甲醇的转化率是$\rm 80\%$,则平衡时参加反应的甲醇的物质的量为$\rm 0.8\ mol$,$\rm C{{H}_{3}}SC{{H}_{3}}$的体积分数为$\rm 5\%$,反应Ⅰ、Ⅱ都是气体分子数不变的反应,则平衡时混合气体的总物质的量为$\rm 3\ mol$,生成的$\rm C{{H}_{3}}SC{{H}_{3}}$的物质的量为:$\rm 3\ mol\times 5\%=0.15\ mol$,生成$\rm C{{H}_{3}}SC{{H}_{3}}$消耗的甲醇的物质的量为$\rm 0.3\ mol$,则生成$\rm C{{H}_{3}}SH$消耗的甲醇的物质的量为$\rm 0.8\ mol-0.3\ mol=0.5\ mol$,生成$\rm C{{H}_{3}}SH$的物质的量为$\rm 0.5\ mol$,故$\rm C{{H}_{3}}SH$的选择性为$\rm \dfrac{0.5\ mol}{0.8\ mol}\times 100\%=62.5\%$。
②根据①的分析可知,平衡时甲醇的物质的量为$\rm 0.2\ mol$,$\rm {{H}_{2}}S$的物质的量为:$\rm 2\ mol-0.5\ mol-0.15\ mol=1.35\ mol$,$\rm C{{H}_{3}}SH$的物质的量为$\rm 0.5\ mol$,水的物质的量为:$\rm 0.5\ mol+0.15\ mol\times 2=0.8\ mol$,则反应Ⅰ的平衡常数${{K}_{\rm p}}=\dfrac{\dfrac{0.8}{3}\times {{p}_{0}}\times \dfrac{0.5}{3}\times {{p}_{0}}}{\dfrac{1.35}{3}\times {{p}_{0}}\times \dfrac{0.2}{3}\times {{p}_{0}}}\approx 1.48$。
甲醇燃料电池不需要燃料的前期预处理,能直接通过特定的方式使甲醇和空气反应产生电流,已广泛应用于电动车,其工作原理如图所示。负极的电极反应为 ,消耗$\rm 0.1\ mol$甲醇时需要消耗标准状况下$\rm {{O}_{2}}$的体积为 $\rm \ L$。
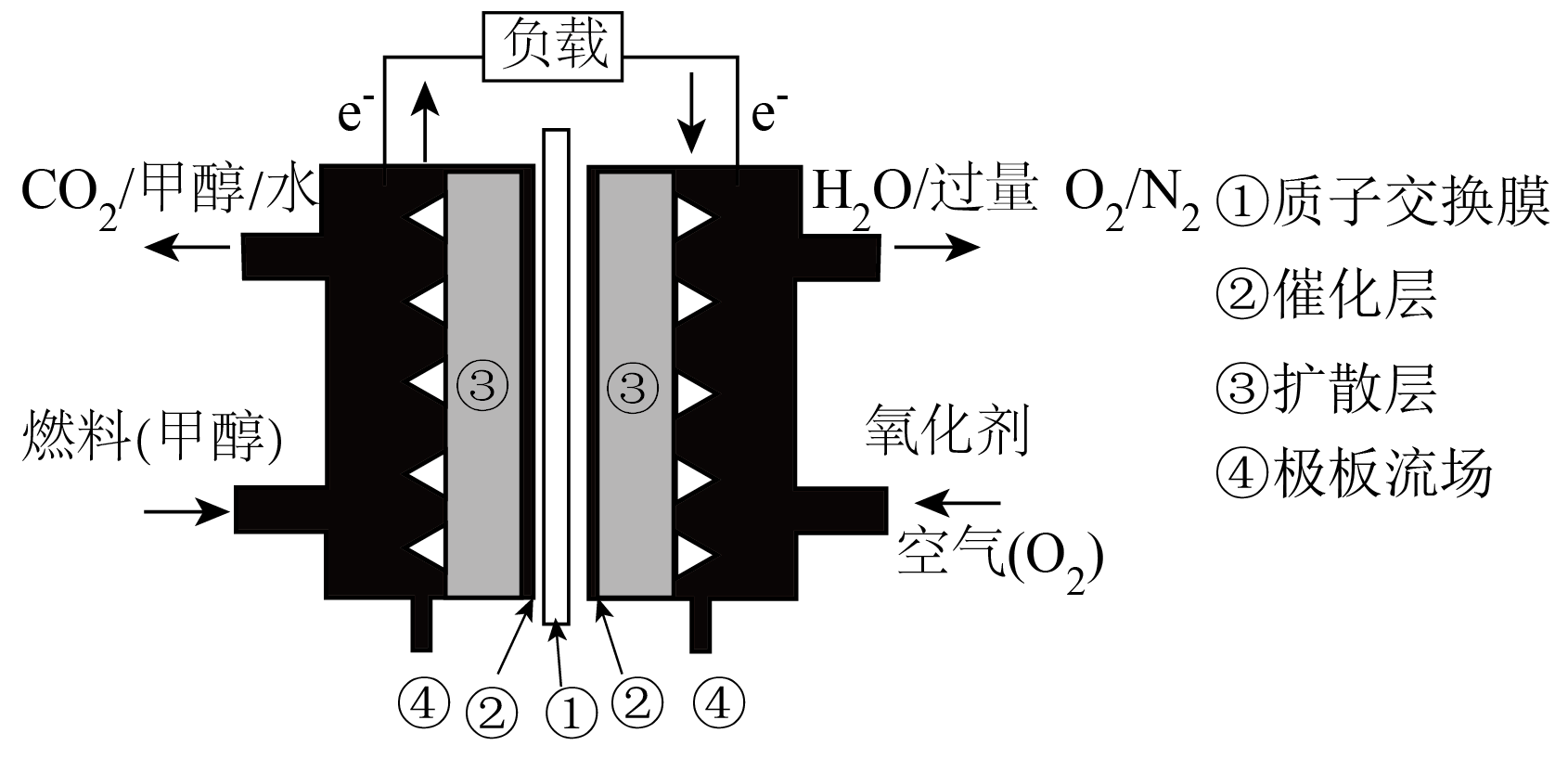
$\\rm C{{H}_{3}}OH+{{H}_{2}}O-6{{e}^{-}}=C{{O}_{2}}\\uparrow +6{{H}^{+}}$;$\\rm 3.36$
"]]根据图示可知,通入甲醇的电极为负极,负极电极反应式为:$\rm C{{H}_{3}}OH+{{H}_{2}}O-6{{e}^{-}}=C{{O}_{2}}\uparrow +6{{H}^{+}}$。已知消耗$\rm 1\ mol\ {{O}_{2}}$得到$\rm 4\ mol\ {{e}^{-}}$,当消耗$\rm 0.1\ mol$甲醇,转移$\rm 0.6\ mol\ {{e}^{-}}$,故消耗氧气$\rm 0.15\ mol$,标准状况下氧气体积为:$\rm 0.15\ mol\times 22.4\ L/mol=3.36\ L$。
高中 | 化学平衡常数题目答案及解析(完整版)
