高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
我国科学家研发出一种乙醇$\rm ($沸点$\rm 78.5\;\rm ^\circ\rm C)$绿色制氢新途径,并实现高附加值乙酸$\rm ($沸点$\rm 118\;\rm ^\circ\rm C)$的生产,主要反应为:
Ⅰ.${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=2{{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)\quad \Delta{{{H}}_{1}}\quad {{{K}}_{\rm p1}}$
Ⅱ.${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)=\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta{{{H}}_{2}}=+68.7\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
回答下列问题:
乙醇可由秸秆生产,主要过程为
秸秆$\xrightarrow{预处理}$纤维素$\xrightarrow{水解}$ $\xrightarrow{发酵}$乙醇
葡萄糖
"]]纤维素水解得到葡萄糖,葡萄糖发酵产生二氧化碳和乙醇;
对于反应Ⅰ:
①已知$\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)={{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)\quad \Delta{ H}=-24.3\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$则$\Delta{{{H}}_{1}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
②一定温度下,下列叙述能说明恒容密闭容器中反应达到平衡状态的是 $\rm ($填标号$\rm )$。
$\rm A$.容器内的压强不再变化
$\rm B$.混合气体的密度不再变化
$\rm C$.$\rm \text{C}{{\text{H}}_{3}}\text{COOH}$的体积分数不再变化
$\rm D$.单位时间内生成$\rm 1\;\rm \text{mol}\ {{\text{H}}_{2}}\text{O}$,同时消耗$\rm 2\;\rm \text{mol}\ {{\text{H}}_{2}}$
③反应后从混合气体分离得到$\rm {{\text{H}}_{2}}$,最适宜的方法为 。
$\\rm +44.4$ ;$\\rm AC$ ;降温冷凝后收集气体
"]]①反应Ⅰ$\rm -$反应Ⅱ得到“已知反应”,根据盖斯定律$\Delta{{{H}}_{\text{1}}}=\Delta{ H+ }\Delta{{{H}}_{2}}\rm =-24.3\;\rm kJ·mol^{-1}+68.7$ $\rm kJ·mol^{-1}=+44.4$ $\rm kJ·mol^{-1}$;
②恒温恒容下发生${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=2{{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right)$:
$\rm A$.该反应是气体总物质的量增大的反应,容器内的压强不再变化,说明气体总物质的量不再改变,说明反应达到平衡状态,$\rm A$符合题意;
$\rm B$.体积自始至终不变,气体总质量自始至终不变,则气体密度不是变量,混合气体的密度不再变化,不能说明反应是否达到平衡状态,$\rm B$不符合题意;
$\rm C$.$\rm \text{C}{{\text{H}}_{3}}\text{COOH}$的体积分数不再变化,说明其物质的量不再改变,反应已达平衡,$\rm C$符合题意;
$\rm D$.单位时间内生成$1\;\rm \text{mol}\ {{\text{H}}_{2}}\text{O}$,同时消耗$2\;\rm \text{mol}\ {{\text{H}}_{2}}$均是逆反应速率,不能说明反应是否达到平衡状态,$\rm D$不符合题意;
③可利用混合体系中各物质的沸点差异分离出氢气,最适宜的方法为降温冷凝后收集气体;
恒压$\rm 100\;\rm kPa$下,向密闭容器中按${n}\left( {{\text{H}}_{2}}\text{O} \right):{n}\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)=9:1$投料,产氢速率和产物的选择性随温度变化关系如图$\rm 1$,关键步骤中间体的能量变化如图$\rm 2$。$\rm [$比如:乙酸选择性$=\dfrac{{n(生成的乙酸}\text{)}}{{n(转化的乙酸}\text{)}}\times 100\%\rm ]$
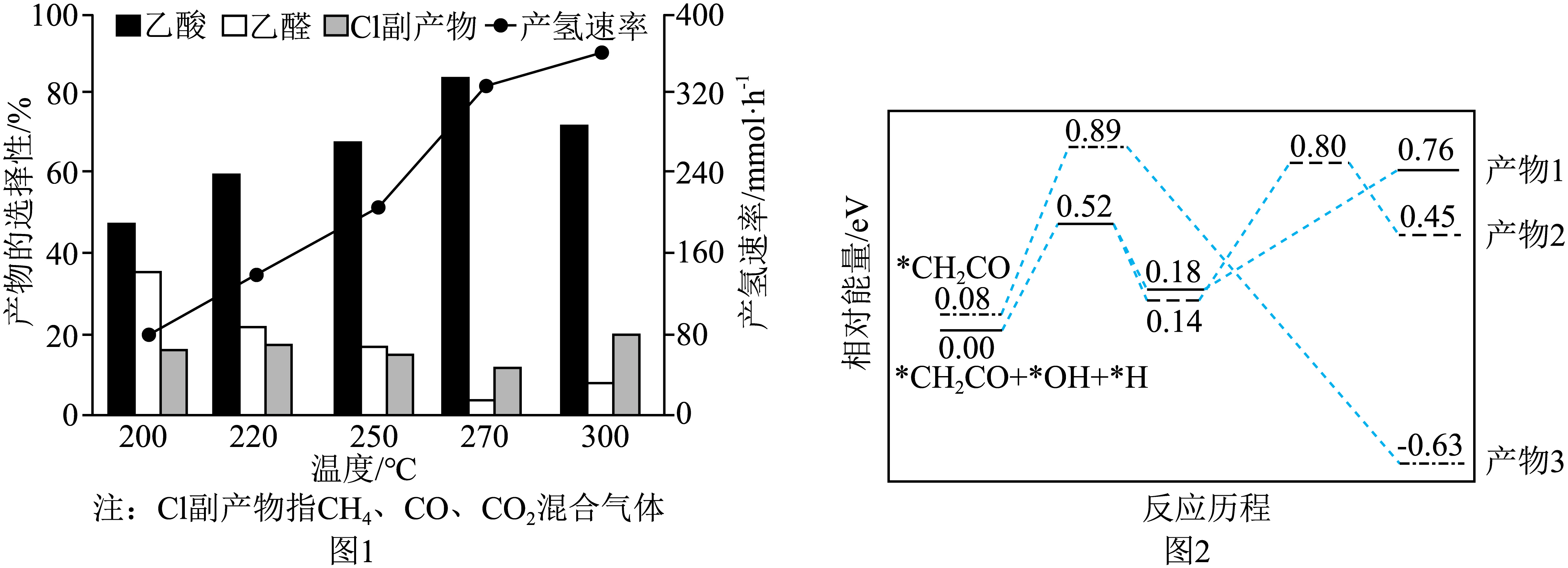
①由图$\rm 1$可知,反应Ⅰ最适宜的温度为$\rm 270\;\rm ^\circ\rm C$,原因为 。
②由图中信息可知,乙酸可能是 $\rm ($填“产物$\rm 1$”“产物$\rm 2$”或“产物$\rm 3$”$\rm )$。
③$\rm 270\;\rm ^\circ\rm C$时,若该密闭容器中只发生反应Ⅰ、Ⅱ,平衡时乙醇的转化率为$\rm 90\%$,乙酸的选择性为$\rm 80\%$,则${p}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right):{p}\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH} \right)=$ ,平衡常数${{{K}}_{\text{p}1}}=$ $\text{kPa}\rm ($列出计算式即可;用平衡分压代替平衡浓度计算,分压$\rm =$总压$\rm \times $物质的量分数$\rm )$。
乙酸选择性最大且反应速率较快; 产物$\\rm 1$; $\\rm 36:5$ ;$\\dfrac{\\text{0}{.72}\\times \\text{100}\\times \\text{1}{.6}{{\\text{2}}^{\\text{2}}}}{\\text{0}{.1}\\times \\text{8}{.28}\\times 10.9}$
"]]①由图$\rm 1$可知,反应Ⅰ最适宜的温度为$\rm 270\;\rm ^\circ\rm C$,原因为乙酸选择性最大且反应速率较快;
②由图$\rm 2$可知关键步骤中生成产物$\rm 1$的最大能垒为$\rm 0.58\;\rm eV$,生成产物$\rm 2$的最大能垒为$\rm 0.66\;\rm eV$,生成产物$\rm 3$的最大能垒为$\rm 0.81\;\rm eV$,图$\rm 1$中乙酸的选择性最大,说明相同条件下生成乙酸的反应速率最大,则乙酸可能是产物$\rm 1$;
③设投料$n(\rm H_{2}O)=9\;\rm mol$,$ n($乙醇$\rm )=1\;\rm mol$,密闭容器中只发生反应Ⅰ、Ⅱ,平衡时乙醇的转化率为$\rm 90\%$,乙酸的选择性为$\rm 80\%$,则平衡时生成的乙酸的物质的量$\rm =90\%\times 80\%\times 1=0.72\;\rm mol$,$n_{平}($乙醇$\rm )=1\;\rm mol\times 10\%=0.1\;\rm mol$,恒温恒压下,压强比$\rm =$物质的量之比,故${p}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right):{p}\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH} \right)=\rm 0.72:0.1=36:5$;列三段式$\begin{matrix} {} \\ \Delta {n(\rm mol)} \\ \end{matrix}\begin{matrix} {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right) \\ 0.72 \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{2}}\text{O}\left( \text{g} \right) \\ 0.72 \\ \end{matrix}\begin{matrix} = \\ {} \\ \end{matrix}\begin{matrix} 2{{\text{H}}_{2}}\left( \text{g} \right) \\ 1.44 \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{3}}\text{COOH}\left( \text{g} \right) \\ 0.72 \\ \end{matrix}$、$\begin{matrix} {} \\ \Delta {n(\rm mol)} \\ \end{matrix}\begin{matrix} {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right) \\ 0.18 \\ \end{matrix}\begin{matrix} = \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{2}}\left( \text{g} \right) \\ 0.18 \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right) \\ 0.18 \\ \end{matrix}$,则平衡时乙醇、$\rm H_{2}O(g)$、氢气、乙酸、乙醛的物质的量分别为$\rm 0.1\;\rm mol$、$\rm 8.28\;\rm mol$、$\rm 1.62\;\rm mol$、$\rm 0.72\;\rm mol$、$\rm 0.18\;\rm mol$,气体总物质的量为$\rm 0.1\;\rm mol+8.28\;\rm mol+1.62\;\rm mol+0.72\;\rm mol+0.18\;\rm mol=10.9\;\rm mol$,则${{K}_{\text{p1}}}=\dfrac{\text{100 kPa}\times \dfrac{\text{0}\text{.72}}{\text{10}\text{.9}}\times {{\text{(100 kPa}\times \dfrac{\text{1}\text{.62}}{\text{10}\text{.9}}\text{)}}^{\text{2}}}}{\text{100 kPa}\times \dfrac{\text{0}\text{.1}}{\text{10}\text{.9}}\times \text{100 kPa}\times \dfrac{\text{8}\text{.28}}{\text{10}\text{.9}}}=\dfrac{\dfrac{\text{0}\text{.72}}{\text{10}\text{.9}}\times \text{100}\times {{\text{(}\dfrac{\text{1}\text{.62}}{\text{10}\text{.9}}\text{)}}^{\text{2}}}}{\dfrac{\text{0}\text{.1}}{\text{10}\text{.9}}\times \dfrac{\text{8}\text{.28}}{\text{10}\text{.9}}}=\dfrac{\text{0}\text{.72}\times \text{100}\times \text{1}\text{.6}{{\text{2}}^{\text{2}}}}{\text{0}\text{.1}\times \text{8}\text{.28}\times 10.9}\text{ kPa}$。
高中 | 化学平衡常数题目答案及解析(完整版)
