高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
Ⅰ.“一碳化学”是以分子中只含一个碳原子的化合物$\rm ($如$\rm CO_{2}$、$\rm CO$、$\rm CH_{4}$等$\rm )$为原料来合成一系列化工原料和燃料的化学。回答下列问题:
二氧化碳加氢制甲醇过程中的主要反应为$\rm ($忽略其他副反应$\rm )$:
①${\rm CO_{2}(g)+H_{2}(g)=CO(g)+H_{2}O(g)}\quad\Delta H_{1}=+41.2{\rm \ kJ\cdot mol^{-1}}\quad K_{1}$
②${\rm CO(g)+2H_{2}(g)=CH_{3}OH(g)}\quad\Delta H_{2}=-90.6{\rm \ kJ\cdot mol^{-1}}\quad K_{2}$
③${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{3}}\quad K_{3}$
则$\Delta{{H}_{3}}=$ $\rm \ kJ\cdot mol^{-1}$,平衡常数$K_{3}=$ $\rm ($用$K_{1}$、$K_{2}$表示$\rm )$。
$\\rm -49.4$; $ K_{1}\\cdot K_{2}$
"]]${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta H_{1}=+41.2\ {\rm kJ\cdot mol^{-1}}\quad K_{1}$,${\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)}\quad\Delta {{H}_{2}}=-90.6{\rm \ kJ\cdot mo{{l}^{-1}}}\quad K_{2}$,${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta {{H}_{3}}\quad K_{3}$,依据盖斯定律,将反应①$\rm +$②得,反应${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta H_{3}=(+41.2\rm \ kJ\cdot mol^{-1})+(-90.6\ kJ\cdot mol^{-1})=-49.4$ $\rm kJ\cdot mol^{-1}$,平衡常数$K_{3}=K_{1}\cdot K_{2}$;
在恒温恒容下,反应$\rm (C{{O}_{2}}(g)+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)$达平衡状态的标志是 $\rm ($填序号$\rm )$。
$\rm A$.平衡常数$K$保持不变
$\rm B$.容器内气体的密度保持不变
$\rm C$.$3{{v}_{正}}{\rm ({{H}_{2}}O)}={{v}_{逆}}\rm ({{H}_{2}})$
$\rm D$.容器内混合气体平均相对分子质量不变
$\\rm CD$
"]]$\rm A$.平衡常数只与温度有关,恒温条件下$\rm K$一定不变,$\rm A$错误;
$\rm B$.反应物和生成物均为气体,则气体总质量不变,容器恒容,则气体总体积不变,所以无论是否达到平衡,容器内气体的密度都不变,$\rm B$错误;
$\rm C$.反应中各物质的化学反应速率之比等于其化学计量数之比,平衡时,$3{{v}_{正}}{\rm ({{H}_{2}}O)}={{v}_{逆}}\rm ({{H}_{2}})$,$\rm C$正确;
$\rm D$.反应前后各物质都是气体,故气体总质量不变,该反应的正反应是气体物质的量减小的反应,混合气体平均相对分子质量不变,即气体分子的物质的量不变,说明反应达到平衡,$\rm D$正确;
欲提高反应$\rm C{{O}_{2}}+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)$中甲醇的平衡产率,可采取的措施有 。
$\rm A$.升高温度
$\rm B$.增大体系压强
$\rm C$.增加$\rm CO_{2}$的浓度
$\rm D$.使用高效催化剂
$\\rm BC$
"]]$\rm A$.该反应为放热反应,升高温度,平衡逆向移动,甲醇产率降低,$\rm A$错误;
$\rm B$.正反应方向为体积减小反应,增大压强平衡正向移动,甲醇产率升高,$\rm B$正确;
$\rm C$.增加二氧化碳浓度,平衡正向移动,甲醇的产率升高,$\rm C$正确;
$\rm D$.催化剂不影响平衡移动,对甲醇的产率无影响,$\rm D$错误;
研究人员研究出一种方法,可实现水泥生产时$\rm CO_{2}$零排放,其基本原理如下图所示。温度小于$\rm 900\ ^\circ \text{C}$时进行电解反应,碳酸钙先分解为$\rm CaO$和$\rm CO_{2}$,电解质为熔融碳酸钠,阳极的电极反应为$\rm 2CO_{3}^{2-}-4{{e}^{-}}=2C{{O}_{2}}\uparrow +{{O}_{2}}\uparrow $则阴极的电极反应为 。
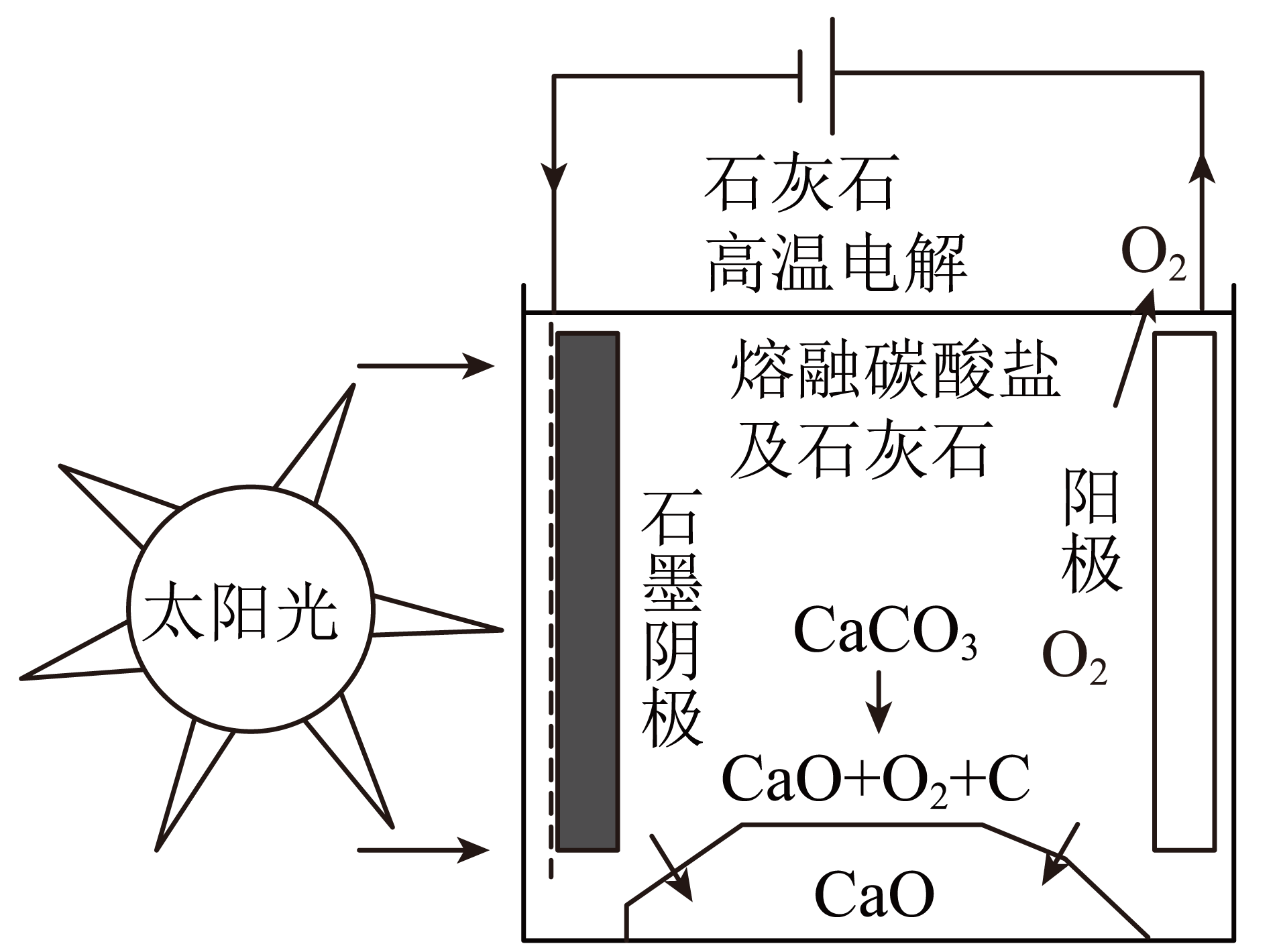
$\\rm 3CO_{2}+4e^{-}=C+2CO_{3}^{2-}$
"]]温度小于$\rm 900\ ^\circ \text{C}$时进行电解反应,碳酸钙先分解为和$\rm CaO$,电解质为熔融碳酸盐,熔融碳酸钠中的碳酸根离子移向阳极,阴极得电子发生还原反应生成碳,则阴极的电极反应为$\rm 3CO_{2}+4e^{-}=C+2CO_{3}^{2-}$;
Ⅱ.亚磷酸$\rm H_{3}PO_{3}$是一种二元弱酸。常温下,已知$\rm H_{3}PO_{3}$溶液中含磷粒子的浓度之和为$\rm 0.1\ mol\cdot L^{-1}$,溶液中含磷粒子的物质的量分数$\rm (\delta)$与溶液$\rm pH$的关系如图所示。
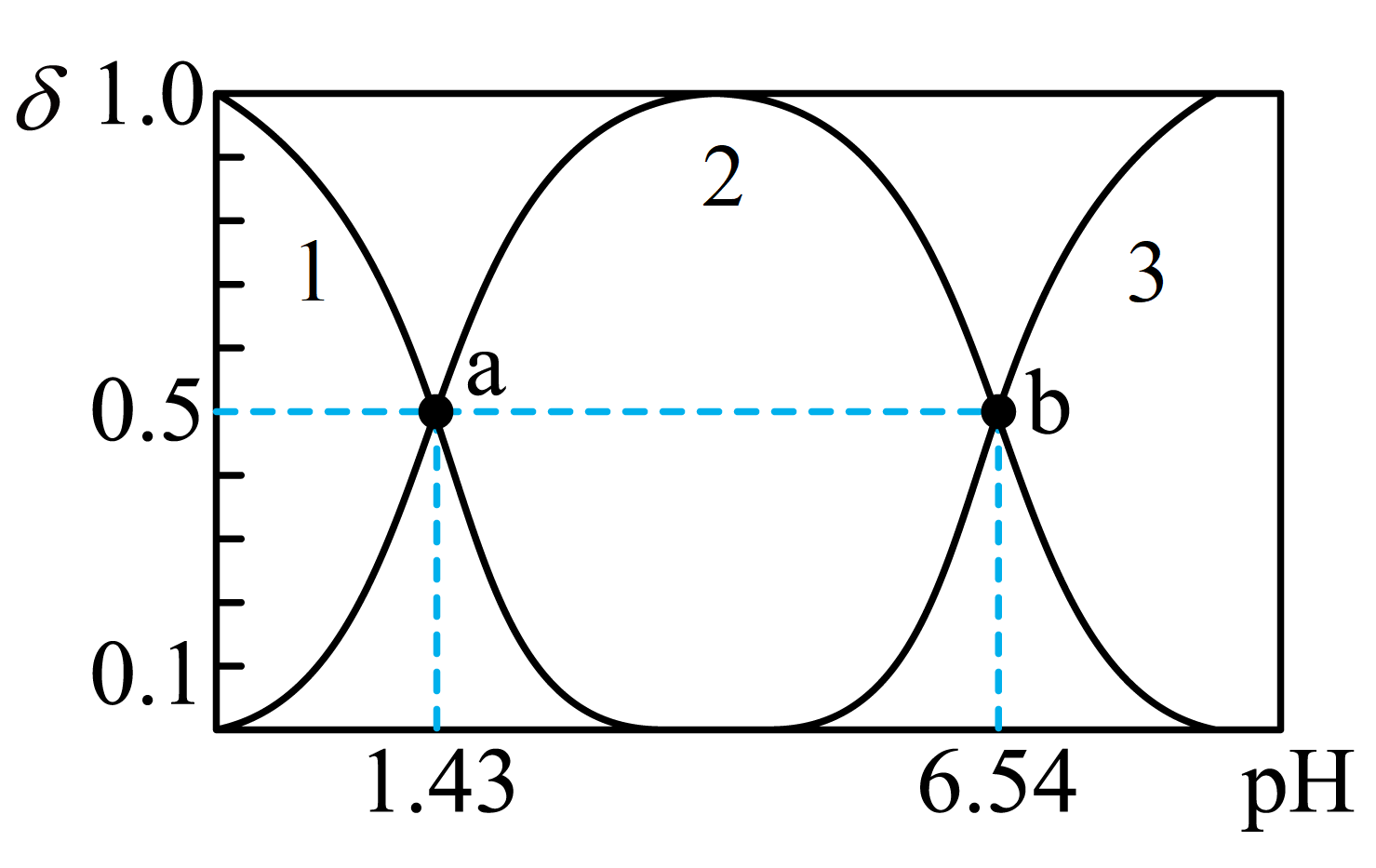
${{K}_{\rm a1}}\rm ({{H}_{3}}P{{O}_{3}})=$ $\rm ($填数值$\rm )$。
$\\rm 10^{-1.43}$
"]]②利用交叉点求算电离平衡常数,$\rm H_{3}PO_{3}\rightleftharpoons H^{+}+{{H}_{2}}PO_{3}^{-}$ $K_{\rm a1}=\dfrac{c{\rm ({{H}^{+}})}c{\rm ({{H}_{2}}PO_{3}^{-})}}{c{\rm ({{H}_{3}}P{{O}_{3}})}}=c{\rm ({{H}^{+}})}=10^{-1.43}$;
$\rm \delta(HPO_{3}^{2-})$随溶液$\rm pH$的变化用曲线 $\rm ($填“$\rm 1$”“$\rm 2$”或“$\rm 3$”$\rm )$表示。
$\\rm 3$
"]]$\rm H_{3}PO_{3}$是二元弱酸,发生电离:$\rm H_{3}PO_{3}\rightleftharpoons H^{+}+{{H}_{2}}PO_{3}^{-}$,$\rm {{H}_{2}}PO_{3}^{-}\rightleftharpoons H^{+}+HPO_{3}^{2-}$,随着溶液中的$\rm pH$逐渐增大,$\rm H_{3}PO_{3}$逐渐减小,$\rm {{H}_{2}}PO_{3}^{-}$逐渐增大后又减小,$\rm HPO_{3}^{2-}$逐渐增大,$\rm \delta(HPO_{3}^{2-})$随溶液$\rm pH$的变化用曲线$\rm 3$。
高中 | 化学平衡常数题目答案及解析(完整版)
