高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
回答下列问题。
镓$\rm (Ga)$与铝同主族,其单质及其化合物具有广泛的工业应用。镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
| 物质 | $\text{GaB}{{\text{r}}_{3}}$ | $\text{GaC}{{\text{l}}_{3}}$ | $\text{Ga}{{\text{F}}_{3}}$ |
| 熔点$\rm /^\circ\rm C$ | $\rm 124$ | $\rm 78$ | $\rm 1000$ |
$\text{GaB}{{\text{r}}_{3}}$的熔点高于$\text{GaC}{{\text{l}}_{3}}$,却远低于$\text{Ga}{{\text{F}}_{3}}$,原因是 。
$\text{GaC}{{\text{l}}_{3}}$气态时常以二聚体形式存在,二聚体中各原子均满足$8{{\text{e}}^{-}}$结构,则$\text{Ga}$与$\text{Cl}$之间存在的化学键有 $\rm ($填字母$\rm )$。
$\rm A$. 极性键 $\rm B$.氢键 $\rm C$.配位键 $\rm D$.离子键 $\rm E$.金属键
$\\text{GaB}{{\\text{r}}_{\\text{3}}}$和$\\text{GaC}{{\\text{l}}_{\\text{3}}}$均为分子晶体,但$\\text{GaB}{{\\text{r}}_{\\text{3}}}$相对分子质量较大,分子间作用力更强,熔点更高;而$\\text{Ga}{{\\text{F}}_{\\text{3}}}$属于离子晶体,熔点最高;$\\rm AC$
"]]①$\text{GaB}{{\text{r}}_{3}}$的熔点高于$\text{GaC}{{\text{l}}_{\text{3}}}$,却远低于$\text{Ga}{{\text{F}}_{\text{3}}}$,原因是:$\text{GaB}{{\text{r}}_{\text{3}}}$和$\text{GaC}{{\text{l}}_{\text{3}}}$均为分子晶体,但$\text{GaB}{{\text{r}}_{\text{3}}}$相对分子质量较大,分子间作用力更强,熔点更高;而$\text{Ga}{{\text{F}}_{\text{3}}}$属于离子晶体,熔点最高;②$\text{GaC}{{\text{l}}_{\text{3}}}$气态时以二聚形式存在,其分子结构类似于$\text{A}{{\text{l}}_{\text{2}}}\text{C}{{\text{l}}_{\text{6}}}$,二聚分子中各原子均满足$8{{\text{e}}^{-}}$结构,$\text{A}{{\text{l}}_{\text{2}}}\text{C}{{\text{l}}_{\text{6}}}$的结构为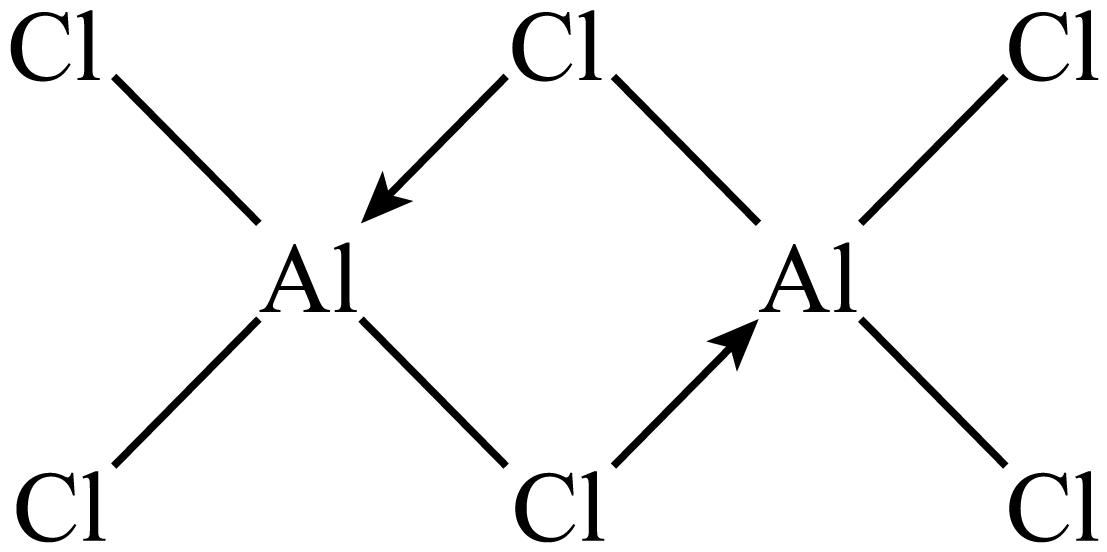 ,则$\rm Ga$与$\rm Cl$之间存在的化学键有极性键、配位键,故选:$\rm AC$;
,则$\rm Ga$与$\rm Cl$之间存在的化学键有极性键、配位键,故选:$\rm AC$;
富硒酵母是一种新型添加剂,硫与硒为同一主族元素,下列事实能比较两者非金属性强弱的是$\rm (\quad\ \ \ \ )$。
稳定性:$\\rm {{\\text{H}}_{2}}\\text{S}\\gt {{\\text{H}}_{2}}\\text{Se}$
","溶解度:$\\rm \\text{S}{{\\text{O}}_{2}}\\gt \\text{Se}{{\\text{O}}_{2}}$
","单质的熔点:$\\rm \\text{Se}\\gt \\text{S}$
","酸性:$\\rm {{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}\\gt {{\\text{H}}_{2}}\\text{Se}{{\\text{O}}_{4}}$
"]$\rm A$.元素非金属性越强,简单氢化物稳定性越强,稳定性:$\rm {{{H}}_{{2}}}{S\gt }{{{H}}_{{2}}}{Se}$,$\rm A$正确;
$\rm B$.溶解度与非金属性强弱无关,$\rm B$错误;
$\rm C$.单质的熔点,与元素的非金属性无关,$\rm C$错误;
$\rm D$.最高价氧化物对应水化物酸性越强,元素非金属性越强,$\rm D$正确;
故选:$\rm AD$;
离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图:
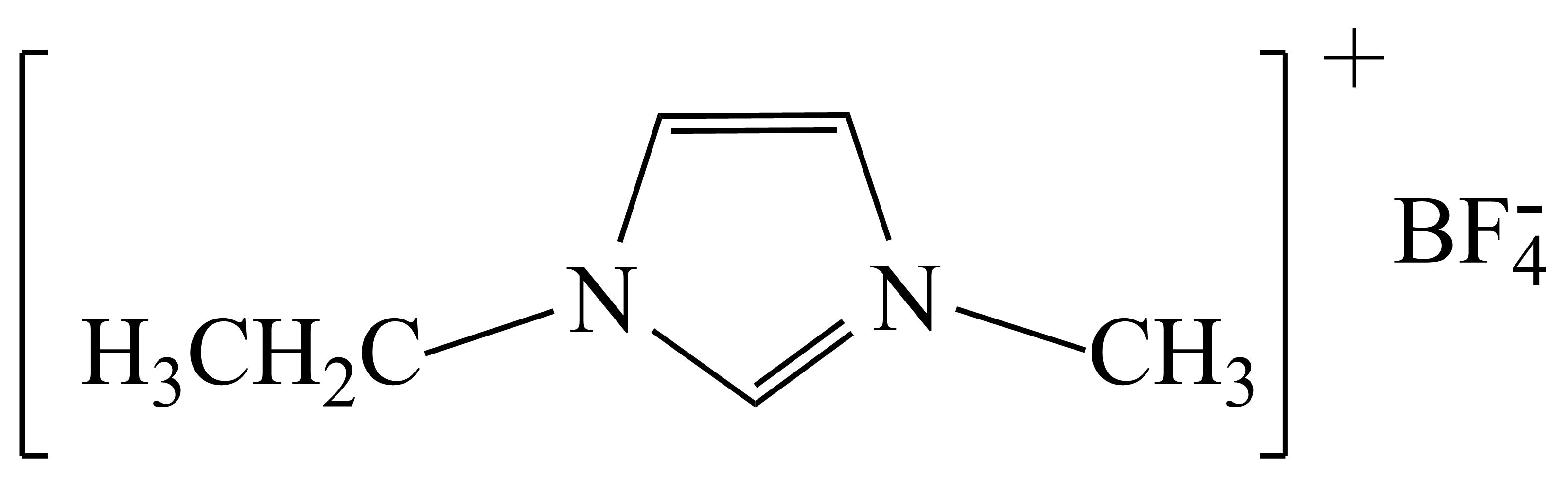
$\rm 1-$乙基$\rm -3-$甲基咪唑四氟硼酸盐$\rm ([Emim]B F )$
①微粒中$\rm F-B-F$键角:$\text{B}{{\text{F}}_{3}}$ $\text{BF}_{4}^{-}\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
②$\text{B}{{\text{F}}_{3}}$可以与$\text{NaF}$反应生成 $\text{NaB}{{\text{F}}_{4}}$的原因是 。
$\\rm \\gt $;$\\rm BF_{3}$中$\\rm B$原子有空轨道,$\\rm F^{-}$有孤电子对,可以形成配位键
"]]①$\rm BF_{3}$中$\rm B$形成$\rm 3$个共价键,且无孤电子对,$\rm B$采取$\rm sp^{2}$杂化,$\text{BF}_{4}^{-}$中$\rm B$形成$\rm 4$个共价键,且无孤电子对,$\rm B$采取$\rm sp^{3}$杂化,所以$\rm F-B-F$键角:$\rm BF_{3}\gt \text{BF}_{4}^{-}$;②$\rm BF_{3}$中$\rm B$原子有空轨道,$\rm F^{-}$有孤电子对,可以形成配位键,故$\text{B}{{\text{F}}_{3}}$可以与$\rm NaF$反应生成$\text{NaB}{{\text{F}}_{4}}$;
$\text{NaF}$等氟化物可以做光导纤维材料,一定条件下,某$\text{NaF}$的晶体结构如下图。${{ {N}}_{\text{A}}}$表示阿伏加德罗常数的值。$\text{NaF}$晶胞为正方体,边长为$ {a\;\rm nm}$,则晶体的摩尔体积$ V\rm_{m}=$ ${{\text{m}}^{\text{3}}}\cdot \text{mo}{{\text{l}}^{-1}}$。

$\\dfrac{{{{N}}_{\\rm {A}}}\\times {{{a}}^{{3}}}{\\times 1}{{{0}}^{{-27}}}}{{4}}$
"]]$\rm Na^{+}$数目为:${6 }\times{ }\dfrac{{1}}{{2}}{+8 }\times{ }\dfrac{{1}}{{8}}{=4}$,$\rm F^{-}$数目为:$12\times \dfrac{1}{4}+1=4$,晶胞的物质的量为:$\dfrac{{4}}{{{{N}}_{\rm {A}}}}\rm \;{mol}$,晶胞体积为:$ (a\times 10^{-9})^{3}\;\rm m^{3}$,则${{{V}}_{\rm {m}}}=\dfrac{{V}}{{n}}=\dfrac{{{\left( {a }\times{ 1}{{{0}}^{{-9}}} \right)}^{{3}}}{{\rm \;{m}}^{{3}}}}{\dfrac{{4}}{{{{N}}_{\rm {A}}}}{\rm \;mol}}=\dfrac{{{{N}}_{\rm {A}}}\times {{{a}}^{{3}}}\times{ 1}{{{0}}^{{-27}}}}{{4}}\rm \;{{{m}}^{{3}}}{/mol}$;
碘酸钾$\rm (KI{{O}_{3}}\rm )$可作为食盐中的补碘剂。工业上用电解法制备碘酸钾($\rm KI{{O}_{3}}$)的装置如图所示。
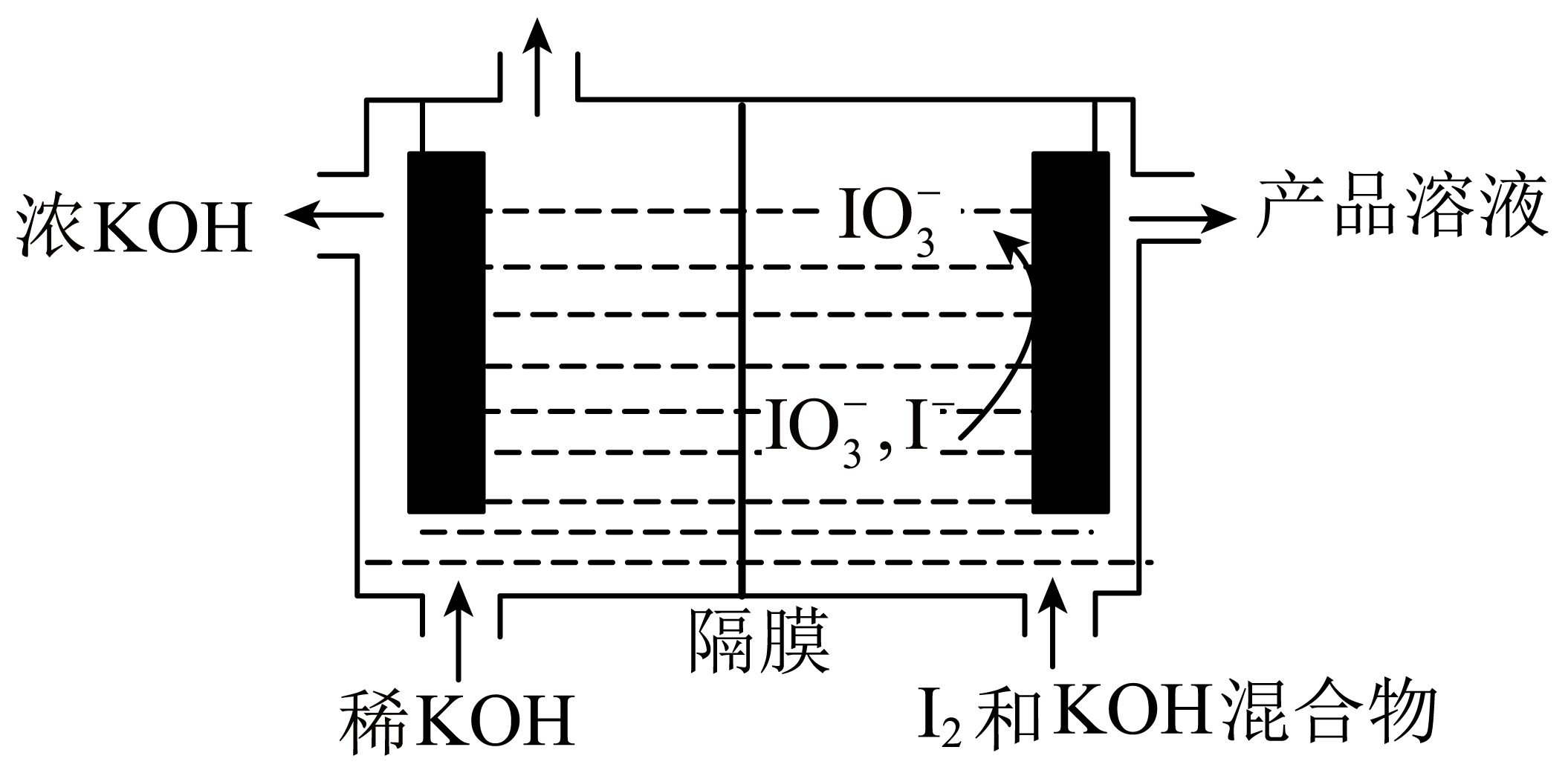
①阳极的电极反应式为 。
②隔膜为 $\rm ($填“阳离子”或“阴离子”$\rm )$交换膜。
③用甲烷燃料电池为该装置供电,消耗 $1\text{ mol C}{{\text{H}}_{4}}$时,理论上可得到 $ \text{mol}{{\text{ H}}_{2}}$。
$\\rm 6OH^{-}+I^{-}-6e^{-}=\\text{IO}_{\\text{3}}^{-}\\rm +3H_{2}O$;阳离子;$\\rm 4$
"]]结合电解池,右侧$\rm I^{-}$失电子为阳极,电极反应方程式为 $\rm 6OH^{-}+I^{-}-6e^{-}=\text{IO}_{\text{3}}^{-}\rm +3H_{2}O$;左侧为阴极,阴极电极反应为$\rm 2H_{2}O +2e^{-}=H_{2}↑+2OH^{-}$,阴极$\rm KOH$溶液由稀变浓;①阳极的电极反应式为$\rm 6OH^{-}+I^{-}-6e^{-}=\text{IO}_{\text{3}}^{-}\rm +3H_{2}O$;②阴极为氢离子放电产生了氢氧根离子,根据出去的是浓$\rm KOH$,可知右侧的钾离子向左边移动,故隔膜为阳离子交换膜;③甲烷燃料电池酸性条件下,负极电极反应:$\rm {C}{{{H}}_{{4}}}{-8}{{{e}}^{{-}}}{+2}{{{H}}_{{2}}}{O=C}{{{O}}_{{2}}}{+8}{{{H}}^{{+}}}$,消耗 $\rm 1\text{ mol C}{{\text{H}}_{4}}$时,转移$\rm 8\;\rm mol$电子,根据阴极电极反应$\rm 2H_{2}O\rm +2e^{-}=H_{2}↑+2OH^{-}$,理论上可得到$\rm \text{4\;\rm mol}{{\text{ H}}_{2}}$。
高中 | 配合物理论题目答案及解析(完整版)
