高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
$25\text{ }{}^\circ \text{C}$时,在浓$\text{NaOH}$溶液中通入过量$\text{C}{{\text{l}}_{\text{2}}}$,充分反应后,可通过调控温度从反应后的固液混合物中获得$\text{NaCl}$和$\text{NaClO}$固体。已知:$\text{NaOH}$、$\text{NaClO}$、$\text{NaCl}$溶解度$(S\rm )$随温度变化关系如下图。
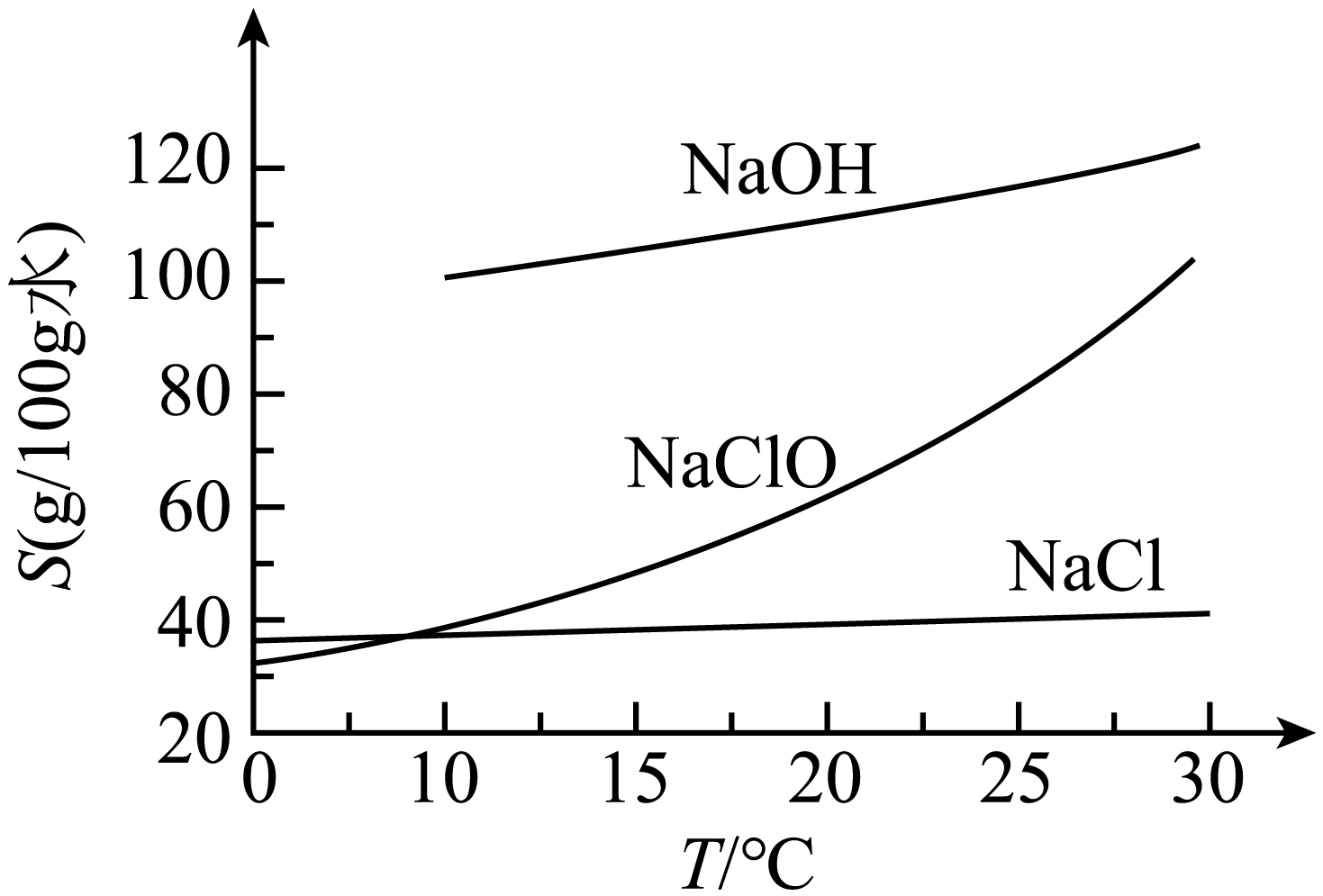
下列说法不正确的是$(\quad\ \ \ \ )$
通入$\\text{C}{{\\text{l}}_{\\text{2}}}$后开始发生反应:$\\mathrm{Cl}_{2}+2 \\mathrm{NaOH}=\\mathrm{NaClO}+\\mathrm{NaCl}+\\mathrm{H}_{2} \\mathrm{O}$
","$25\\ {}^\\circ \\text{C}$时,随反应进行$\\text{NaCl}$先析出
","将反应后的固液混合物过滤,滤液降温可析出$\\text{NaClO}$固体
","在冷却结晶的过程中,大量$\\text{NaOH}$会和$\\text{NaClO}$一起析出
"]$\rm A$.氯气与氢氧化钠反应,生成氯化钠,次氯酸钠和水,开始发生反应为$\mathrm{Cl}_{2}+2 \mathrm{NaOH}=\mathrm{NaClO}+\mathrm{NaCl}+\mathrm{H}_{2} \mathrm{O}$,$\rm A$正确;
$\rm B$.$25\ {}^\circ \text{C}$时,氯化钠溶解度最小,随反应进行,$\text{NaCl}$逐渐增多,则最先析出,$\rm B$正确;
$\rm C$.由于次氯酸钠的溶解度随温度的变化趋势较大,将反应后的固液混合物过滤,滤液降温可析出$\text{NaClO}$固体,$\rm C$正确;
$\rm D$.由于氢氧化钠的溶解度随温度的变化趋势较小,次氯酸钠的溶解度随温度的变化趋势较大,在冷却结晶的过程中,$\text{NaClO}$会大量析出,氢氧化钠则不会,$\rm D$错误;
故选:$\rm D$
高中 | 氯气题目答案及解析(完整版)
