高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中$\operatorname{E}$瓶放有干燥红色布条;$\operatorname{F}$中为红色的铜网,其右端出气管口放有脱脂棉。
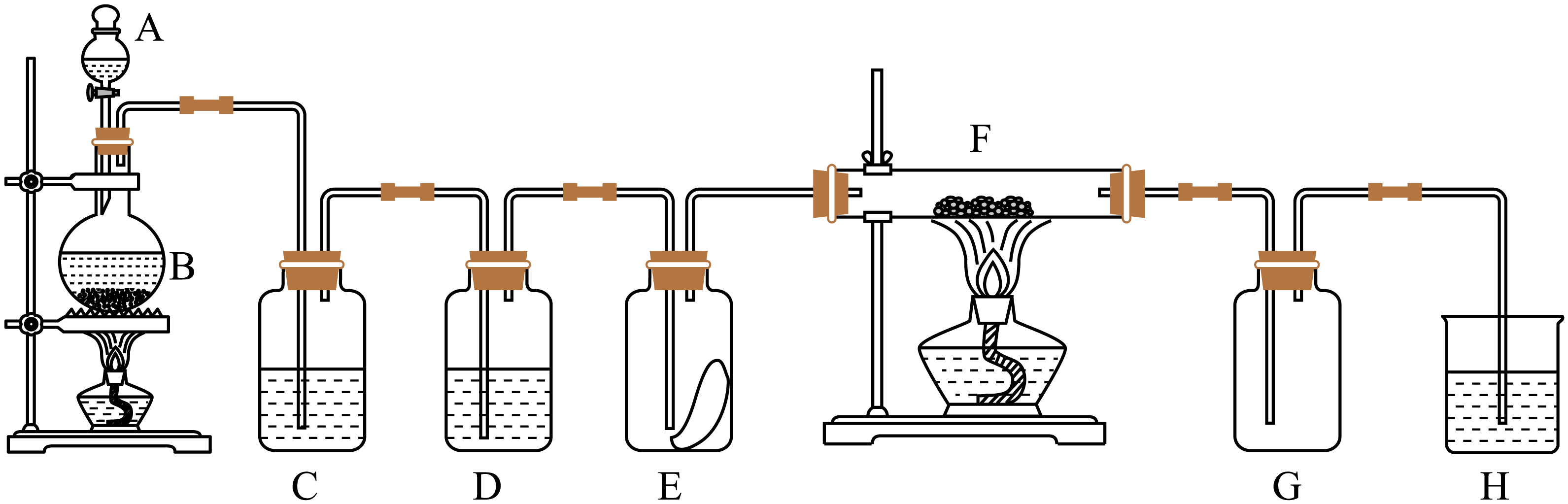
$\rm A$装置的名称为
分液漏斗
"]]A装置的名称为分液漏斗。
$\rm B$中发生反应的化学方程式为 ;
$\\rm \\text{Mn}{{\\text{O}}_{2\\ }}+4\\text{HCl}($浓$\\rm )=\\text{MnC}{{\\text{l}}_{2\\ }}+\\text{C}{{\\text{l}}_{2}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}$
"]]$\rm B$中$\rm MnO_{2}$和浓盐酸加热反应制取氯气,反应的化学方程式为:$\rm \text{Mn}{{\text{O}}_{2\ }}+4\text{HCl}($浓$\rm )=\text{MnC}{{\text{l}}_{2\ }}+\text{C}{{\text{l}}_{2}}\uparrow +2{{\text{H}}_{2}}\text{O}$。
装置$\operatorname{C}$中盛装的溶液是 ,$\operatorname{D}$中试剂的作用是 。
饱和食盐水;干燥氯气
"]]根据装置图分析可知$\rm C$装置用于除去氯气中的氯化氢气体,所以可以选用饱和食盐水,$\rm D$装置主要用于干燥氯气。
$\rm E$中的红色布条是否褪色? 。$\rm ($填“是”或“否”$\rm )$写出$\rm \operatorname{F}$中反应的反应现象为 。
否;产生大量棕黄色烟
"]]干燥的氯气没有漂白性,不能使红色布条褪色;$\rm F$中铜和氯气在加热条件下反应产生氯化铜,实验现象为形成棕黄色烟。
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为$6.72\text{ L}$。则反应中被氧化的$\text{HCl}$的物质的量为 。
$0.6\\text{ mol}$
"]]$\rm \text{Mn}{{\text{O}}_{2\ }}+4\text{HCl}($浓$\rm )= \text{MnC}{{\text{l}}_{2\ }}+\text{C}{{\text{l}}_{2}}\uparrow +2{{\text{H}}_{2}}\text{O}$中$\rm Cl$元素部分由$\rm -1$价上升到$\rm 0$价生成$\rm Cl_{2}$,产生的氯气在标准状况下的体积为$\rm 6.72\text{ L}$,$\rm Cl_{2}$的物质的量为$\rm \dfrac{\text{6}\text{.72 L}}{\text{22}\text{.4 L/mol}} =0.3\;mol$,则反应中被氧化的$\rm \text{HCl}$的物质的量为$\rm 0.6\;mol$。
$\rm H$中的试剂为 ,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂粉精,该反应的化学方程式为: 。
氢氧化钠溶液;$2\\text{C}{{\\text{l}}_{2}}+2\\text{Ca}{{(\\text{OH})}_{2}}=\\text{CaC}{{\\text{l}}_{2}}+\\text{Ca}{{(\\text{ClO})}_{2}}+2{{\\text{H}}_{2}}\\text{O}$
"]]$\rm H$的主要作用是吸收氯气,防止污染大气,所以应选用氢氧化钠溶液,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为:$\rm 2\text{C}{{\text{l}}_{2}}+2\text{Ca}{{(\text{OH})}_{2}}=\text{CaC}{{\text{l}}_{2}}+\text{Ca}{{(\text{ClO})}_{2}}+2{{\text{H}}_{2}}\text{O}$。
高中 | 氯气题目答案及解析(完整版)
