高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
三氯化六氨合钴$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$是一种重要的化工原料。利用含钴废料$\rm ($含少量$\text{Fe}$、$\text{Al}$等杂质$\rm )$制取$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$的工艺流程如下所示:
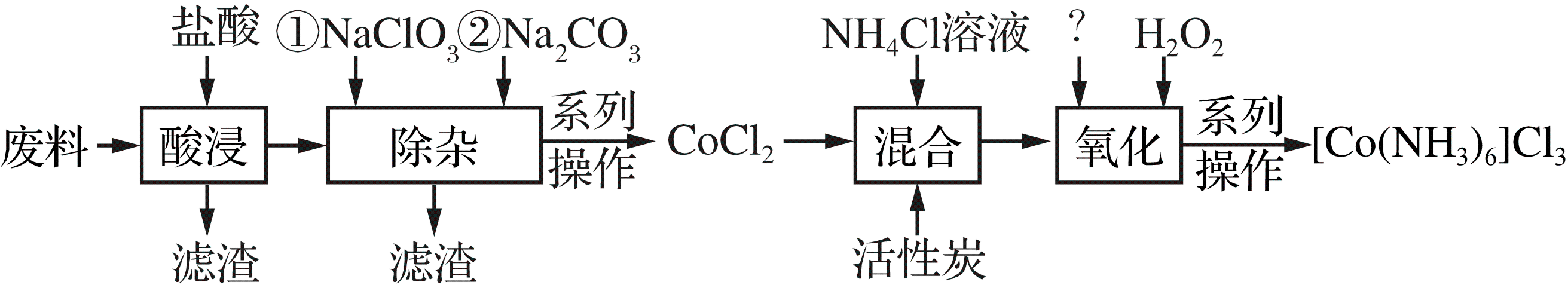
已知:①“酸浸”过滤后的滤液中含有$\text{C}{{\text{o}}^{2+}}$、$\text{F}{{\text{e}}^{2+}}$、$\text{F}{{\text{e}}^{3+}}$、$\text{A}{{\text{l}}^{3+}}$等。
②$\text{Co}{{(\text{OH})}_{2}}$、$\text{Co}{{(\text{OH})}_{3}}$均为难溶物。
③${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}}$具有较强还原性。
回答下列问题:
制备$\text{CoC}{{\text{l}}_{2}}$。“除杂”过程中加入$\text{NaCl}{{\text{O}}_{3}}$的作用是 。
将$\\text{F}{{\\text{e}}^{2+}}$氧化成$\\text{F}{{\\text{e}}^{3+}}$,便于后续去除
"]]由分析可知,加入适量的$\rm NaClO_{3}$的作用是将$\rm Fe^{2+}$氧化为$\rm Fe^{3+}$,便于后续除去;
制备${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{3+}}$。
①“氧化”过程应先加入 $\rm ($填序号$\rm )$,原因是 。
$\rm A$.氨水 $\rm B$.氢氧化钠 $\rm C$.$\rm \text{Co}{{(\text{OH})}_{2}}$ $\rm D$.$\rm \text{Co}{{(\text{OH})}_{3}}$
②生成${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{3+}}$的离子方程式为 。
$\\rm A$ ; ${{\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_3} \\right)}_6} \\right]}^{2+}}$具有较强还原性,易被氧化,若先加${{\\text{H}}_{2}}{{\\text{O}}_{2}}$将$\\text{C}{{\\text{o}}^{2+}}$氧化为$\\text{C}{{\\text{o}}^{3+}}$,后加氨水,会生成$\\text{Co}{{(\\text{OH})}_{3}}$沉淀,不利于产品的生成 ; $2{{\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{6}} \\right]}^{2+}}+2\\text{NH}_{4}^{+}+{{\\text{H}}_{2}}{{\\text{O}}_{2}}=2{{\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{6}} \\right]}^{3+}}+2\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}$
"]]①结合分析可知,若先加$\rm H_{2}O_{2}$,将$\rm Co$元素氧化到$\rm Co^{3+}$,后加氨水,会生成$\rm Co(OH)_{3}$,不利于产品的生成,故先加入氨水再加入$\rm H_{2}O_{2}$,可防止$\rm Co(OH)_{3}$的生成,原因为;$\rm [Co(NH_{3})_{6}]^{2+}$具有较强还原性,易被氧化;先加$\rm H_{2}O_{2}$将$\rm Co^{2+}$氧化为$\rm Co^{3+}$,后加氨水,会生成$\rm Co(OH)_{3}$,不利于产品的生成,故先加入氨水再加入$\rm H_{2}O_{2}$;
②由分析可知,生成$\rm [Co(NH_{3})_{6}]^{3+}$的反应方程式为:$\rm H_{2}O_{2}+2[Co(NH_{3})_{6}]Cl_{2}+2NH_{4}Cl=2[Co(NH_{3})_{6}]Cl_{3}+2NH_{3}↑+2H_{2}O$,则其离子方程式为$\rm 2[Co(NH_{3})_{6}]^{2+}+2\text{NH}_{\text{4}}^{+}\rm +H_{2}O_{2}=2[Co(NH_{3})_{6}]^{3+}+2NH_{3}↑+2H_{2}O$;
得到$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$晶体。${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{3+}}$中中心原子配位数是 。
$\\rm 6$
"]]$\rm [Co(NH_{3})_{6}]^{3+}$中配位原子是$\rm N$,配位数是$\rm 6$;
含量测定。通过碘量法可测定产品中的钴元素的含量。称取$\rm 0.20$ $\rm g$产品,加入稍过量的$\rm NaOH$溶液并加热,将$\rm Co$元素完全转化为难溶的$\text{Co}{{(\text{OH})}_{3}}$,过滤洗涤后将滤渣完全溶于盐酸中,向所得的溶液中加入过量的$\rm KI$和$2\sim3$滴淀粉溶液,再用$0.010\ \text{mol}\cdot {{\text{L}}^{-1}}$的$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液滴定$\rm ($反应原理:$\text{C}{{\text{o}}^{3+}}+{{\text{I}}^{-}}\xrightarrow[{}]{{}}\text{C}{{\text{o}}^{2+}}+{{\text{I}}_{2}}$、${{\text{I}}_{2}}+{{\text{S}}_{2}}\text{O}_{3}^{2-}\xrightarrow[{}]{{}}{{\text{I}}^{-}}+{{\text{S}}_{4}}\text{O}_{6}^{2-}\rm )$,达到滴定终点时消耗$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液$\rm 48.00$ $\rm mL$,试求产品中钴元素的百分含量$\rm ($写出解题过程$\rm )$ 。
$14.16 \\%$
"]]根据得失电子守恒可得关系式:$2\text{C}{{\text{o}}^{3+}}\sim{{\text{I}}_{2}}\sim2{{\text{S}}_{2}}\text{O}_{3}^{2-}$,$n\left( \text{C}{{\text{o}}^{3+}} \right)=n\left( {{\text{S}}_{2}}\text{O}_{3}^{2-} \right)=0.010\,\text{mol}\cdot {{\text{L}}^{-1}}\times 0.048\,\text{L}=4.8\times {{10}^{-4}}\ \text{mol}$,$m\left( \text{C}{{\text{o}}^{3+}} \right)=4.8\times {{10}^{-4}}\,\text{mol}\times 59\,\text{g}\cdot \text{mo}{{\text{l}}^{-1}}=0.02832\,\text{g}$,产品中钴元素的百分含量为$\dfrac{0.02832\ \text{g}}{0.20\ \text{g}}\times 100\%=14.16\%$。
高中 | 配合物理论题目答案及解析(完整版)
