高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
甲醇$\rm (CH_{3}OH)$、甲酸甲酯$\rm (HCOOCH_{3})$均是用途广泛的化工原料。请回答:
二氧化碳加氢制甲醇的总反应:$\rm CO_{2}(g)+3H_{2}(g)⇌CH_{3}OH(g)+H_{2}O(g)$,一般认为该反应分为两步,体系能量$\rm -$反应进程如图所示:
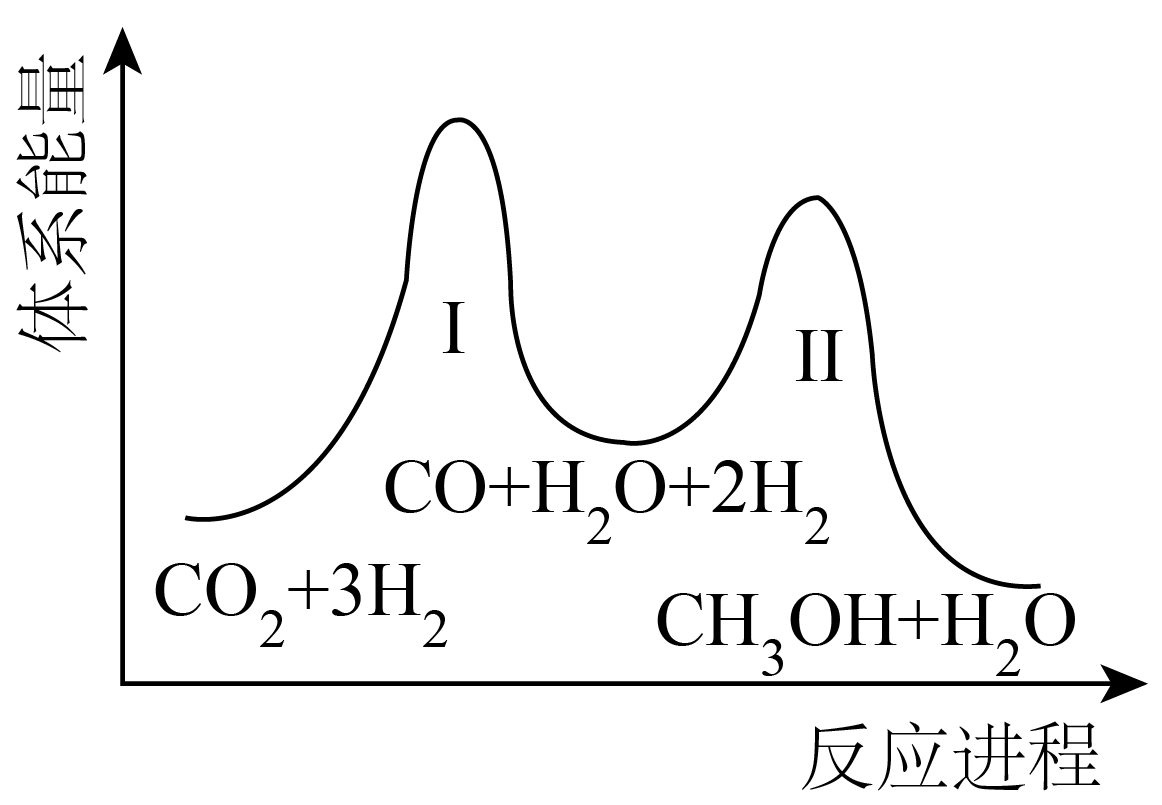
①一定条件下,反应Ⅰ能自发进行,则反应Ⅰ在该条件下的$\Delta S$ $\rm 0($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
②下列说法不正确的是 。
$\rm A$.反应Ⅱ:$\rm CO_{2}(g)+H_{2}(g)⇌CO(g)+H_{2}O(g)$ $\Delta H\gt 0$
$\rm B$.上述反应建立平衡后,移走$\rm CH_{3}OH$,反应Ⅰ、Ⅱ平衡均右移
$\rm C$.适当升温有利于提高一定时间内反应的速率和产率
$\rm D$.催化剂能提高甲醇的平衡转化率
$\\rm \\gt $ ;$\\rm AD$
"]]①由图可知,反应$\rm I$的$\Delta H\gt 0$,自发进行:$\Delta G=\Delta H-T\Delta S\lt 0$,则$\Delta S\gt 0$;
②$\rm A$.如图可知,反应Ⅱ:${\rm CO(g)+2H_{2}(g)⇌CH_{3}OH(g)}\quad\Delta H\lt 0$,故$\rm A$错误;
$\rm B$.上述反应建立平衡后,移走$\rm CH_{3}OH$,反应Ⅱ平衡右移,$\rm CO$减少,反应Ⅰ平衡右移,故$\rm B$正确;
$\rm C$.反应Ⅰ吸热,反应Ⅱ放热,升高温度,反应Ⅰ和反应Ⅱ的速率均增加,但反应Ⅰ平衡正向移动,反应Ⅱ平衡逆向移动,因此适当升温有利于提高一定时间内反应的速率和产率,故$\rm C$正确;
$\rm D$.催化剂不能改变化学平衡,不能提高甲醇的平衡转化率,故$\rm D$错误。
通过电解含有甲醇的$\rm NaOH$溶液可用于制备甲酸盐,生成甲酸盐的电极反应式为 。
$\\rm CH_{3}OH-4e^{-}+5OH^{-}=HCOO^{-}+4H_{2}O$
"]]碱性条件下电解甲醇生成甲酸盐的电极反应式为$\rm CH_{3}OH-4e^{-}+5OH^{-}=HCOO^{-}+4H_{2}O$。
已知$\rm HCOONa$的$K_{\rm h}=5.6\times 10^{-9}$,若电解一段时间后所得$\rm HCOONa$溶液的浓度为$\rm 1.8\ mol/L$,则将$\rm HCOONa$溶液完全转化为$\rm HCOOH$溶液需调节溶液中$\rm H^{+}$浓度约为 ,所得甲酸溶液进一步处理后可用于制备甲酸甲酯。
$\\rm 0.32\\ mol/L$
"]]$\rm HCOONa$水解产生$\rm HCOOH$:$\rm HCOO^{-}+H_{2}O⇌HCOOH+OH^{-}$,初始$\rm HCOO^{-}$浓度为$\rm 1.8\ mol/L$,$\rm HCOONa$溶液完全转化为$\rm HCOOH$溶液时$\rm HCOO^{-}$浓度为$\rm 1\times 10^{-5}\ mol/L$,$\rm HCOOH$浓度为$\rm (1.8-1\times 10^{-5})\ mol/L$,则根据${{K}_{\rm h}}=\dfrac{c{\rm (HCOOH)}c{\rm (O{{H}^{-}})}}{c{\rm (HCO{{O}^{-}})}}=5.6\times {{10}^{-9}}$,此时溶液中$\rm OH^{-}$浓度约为$c{\rm (O{{H}^{-}})}=\dfrac{{{K}_{\rm h}}\rm (HCO{{O}^{-}})}{c{\rm (HCOOH)}}=\dfrac{5.6\times {{10}^{-9}}\times 1\times {{10}^{-5}}}{(1.8-1\times {{10}^{-5}})}\rm \ mol/L\approx \dfrac{5.6\times {{10}^{-9}}\times 1\times {{10}^{-5}}}{1.8}\ mol/L=3.1\times {{10}^{-14}}\ mol/L$,则$c{\rm ({{H}^{+}})}=\dfrac{{{K}_{\rm w}}}{c{\rm (O{{H}^{-}})}}=\dfrac{1\times {{10}^{-14}}}{3.1\times {{10}^{-14}}}\rm \ mol/L=0.32\ mol/L$。
甲醇催化氧化也可用于制备甲酸甲酯,其工艺过程包含以下反应:
Ⅲ:$\rm 2CH_{3}OH(g)+O_{2}(g)⇌HCOOCH_{3}(g)+2H_{2}O(g)$ $\Delta H=+51.2\rm \ kJ\cdot mol^{-1}$
Ⅳ:$\rm HCOOCH_{3}(g)⇌2CO(g)+2H_{2}(g)$ $\Delta H=+129.1\rm \ kJ\cdot mol^{-1}$
已知:$\rm CH_{3}OH$和$\rm O_{2}$在催化剂表面的反应过程如下$\rm (M$*表示催化剂表面的吸附物种,部分产物已省略$\rm )$
$\rm a$.氧在催化剂表面活化:$\rm O_{2}→2O$*
$\rm b$.甲醇的化学吸附:$\rm CH_{3}OH+O$*$\rm →CH_{3}O$*
$\rm c$.生成弱吸附的甲醛:$\rm CH_{3}O$*$\rm +O$*$\rm →HCHO$*
$\rm d$.生成甲酸甲酯并脱附:$\rm HCHO$*$\rm +CH_{3}O$*$\rm →HCOOCH_{3}$
①步骤$\rm b$是$\rm HCOOCH_{3}$合成决速步骤,在相同的温度和压强下,以一定的流速通过不同的催化剂表面,反应相同时间,测得实验数据如下:
| $T\rm (K)$ | 催化剂 | 甲醇氧化为甲醛的转化率 | 甲酸甲酯的选择性 |
| $\rm 353$ | $\rm Au$@$\rm SiO_{2}$ | $\rm 40\%$ | $\rm 98\%$ |
| $\rm 353$ | $\rm Au^{\delta+}$@$\rm SiO_{2}$ | $\rm 85\%$ | $\rm 100\%$ |
研究表明在金离子存在的条件下,甲酸甲酯的产率明显提高,可能原因是 。
②实际工业生产中,采用的温度约为$\rm 353\ K$,温度不能太高的理由是$\rm ($不考虑催化剂活性降低活失活$\rm )$ 。
在$\\rm Au$离子存在下,有利于促进甲醇的化学吸附,提高生成甲酸甲酯的速率; 反应Ⅳ是吸热反应,温度升高,平衡正移,甲酸甲酯易分解生成$\\rm CO$和$\\rm H_{2}$,产率降低;温度升高,不利于反应物$\\rm O_{2}$、甲醇的吸附
"]]①步骤$\rm b$是$\rm HCOOCH_{3}$合成决速步骤,在金离子存在的条件下,甲酸甲酯的产率明显提高,可能原因是:在$\rm Au$离子存在下,有利于促进甲醇的化学吸附,提高生成甲酸甲酯的速率;
②实际工业生产中,采用的温度约为$\rm 353\ K$,温度不能太高的理由是:反应Ⅳ是吸热反应,温度升高,平衡正移,甲酸甲酯易分解生成$\rm CO$和$\rm H_{2}$,产率降低;温度升高,不利于反应物$\rm O_{2}$、甲醇的吸附。
高中 | 盐类水解常数题目答案及解析(完整版)
