高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
常温下,一元有机弱酸$\text{HC}\equiv \text{CCOOH}$、$\text{C}{{\text{H}}_{2}}=\text{CHCOOH}$、$\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{COOH}$的三种溶液中,分布系数$\rm \delta$与$\rm pH$的关系如图所示,下列说法正确的是$(\quad\ \ \ \ )$
已知:①一元弱酸分布分数可表示为$\delta\left( \text{HA} \right)=\dfrac{c\left( \text{HA} \right)}{c\left( \text{HA} \right)+c\left( {{\text{A}}^{-}} \right)}$;
②杂化轨道中$\rm s$成分越多,$\rm C$的电负性越大。
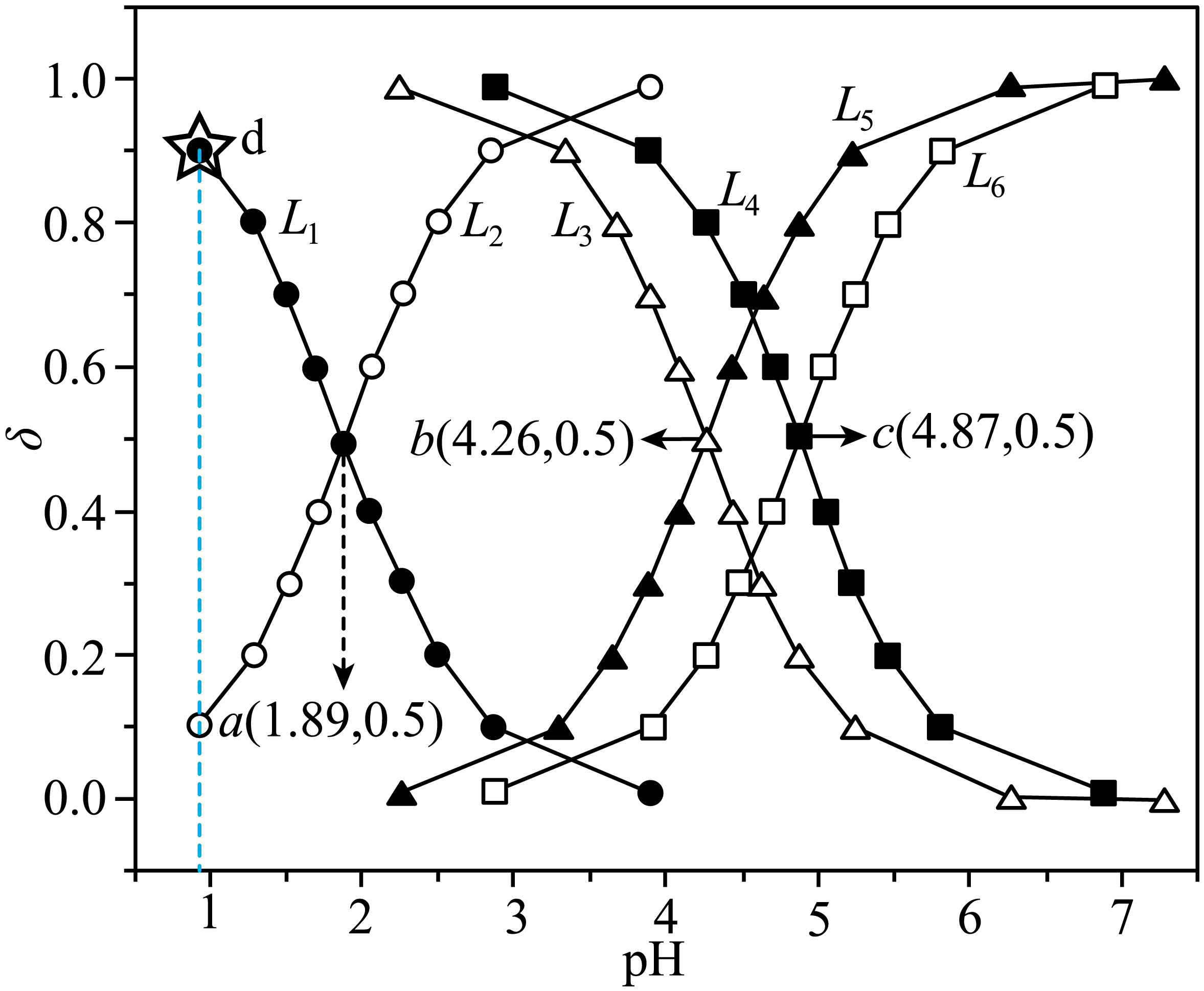
曲线${{\\text{L}}_{5}}$代表微粒$\\text{C}{{\\text{H}}_{3}}\\text{C}{{\\text{H}}_{2}}\\text{COOH}$的分布系数随$\\rm pH$变化关系
","浓度均为$0.10\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}$的$\\text{C}{{\\text{H}}_{2}}=\\text{CHCOOH}$和$\\text{C}{{\\text{H}}_{2}}=\\text{CHCOONa}$的混合溶液的$\\text{pH}=4.26$
","若酸的初始浓度$0.10\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}$,则$\\rm a$点$c\\left( \\text{HC}\\equiv \\text{CCO}{{\\text{O}}^{-}} \\right)$大于$\\rm c$点$c\\left( \\text{C}{{\\text{H}}_{3}}\\text{C}{{\\text{H}}_{2}}\\text{CO}{{\\text{O}}^{-}} \\right)$
","若酸的初始浓度$0.10\\,\\text{mol}\\cdot {{\\text{L}}^{-1}}$,则$\\rm d$点对应的溶液中有$c\\left( {{\\text{H}}^{+}} \\right)=c\\left( \\text{HC}\\equiv \\text{CCO}{{\\text{O}}^{-}} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
"]由题意可知,杂化轨道中$\rm s$成分越多,碳元素的电负性越大,羧酸的酸性越强,则丙炔酸、丙烯酸、丙酸的酸性依次减弱,电离常数依次减弱,等浓度的酸溶液的$\rm pH$越小,则曲线$\rm L_{1}$、$\rm L_{2}$、$\rm L_{3}$、$\rm L_{4}$、$\rm L_{5}$、$\rm L_{6}$分别表示$\rm HC≡CCOOH$、$\rm HC≡CCOO^{-}$、$\rm CH_{2}=CHCOOH$、$\rm CH_{3}CH_{2}COOH$、$\rm CH_{2}=CHCOO^{-}$、$\rm CH_{3}CH_{2}COO^{-}$的分布系数随$\rm pH$变化关系;由图可知,$\rm HC≡CCOOH$和$\rm HC≡CCOO^{-}$的浓度相等时,溶液$\rm pH$为$\rm 1.89$,则丙炔酸的电离常数${{K}_{\text{a}}}=\dfrac{c\left( \text{HC}\equiv \text{CCO}{{\text{O}}^{-}} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( \text{HC}\equiv \text{CCOOH} \right)}=c\left( {{\text{H}}^{+}} \right)={{10}^{-1.89}}$,同理可知,丙烯酸、丙酸的电离常数${{K}_{\text{a}}}$分别为$\rm 10^{-4.26}$、$\rm 10^{-4.87}$。
$\rm A$.由分析可知,曲线$\rm L_{1}$、$\rm L_{2}$、$\rm L_{3}$、$\rm L_{4}$、$\rm L_{5}$、$\rm L_{6}$分别表示$\rm HC≡CCOOH$、$\rm HC≡CCOO^{-}$、$\rm CH_{2}=CHCOOH$、$\rm CH_{3}CH_{2}COOH$、$\rm CH_{2}=CHCOO^{-}$、$\rm CH_{3}CH_{2}COO^{-}$的分布系数随$\rm pH$变化关系,故$\rm A$错误;
$\rm B$.由分析可知,丙烯酸的电离常数${{K}_{\text{a}}}={{10}^{-4.26}}$,则丙烯酸根离子在溶液中的水解常数${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a}}}}=\dfrac{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-14}}}{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-4.26}}}\lt {{K}_{\text{a}}}$,所以等浓度的丙烯酸和丙烯酸钠混合溶液中,丙烯酸的电离程度大于丙烯酸根离子,丙烯酸的浓度小于丙烯酸根离子,由图可知,丙烯酸的浓度等于丙烯酸根离子时,溶液$\rm pH$为$\rm 4.26$,则浓度均为$\rm 0.1$ $\rm mol/L$的丙烯酸和丙烯酸钠混合溶液的$\rm pH$小于$\rm 4.26$,故$\rm B$错误;
$\rm C$.由分析可知,丙炔酸的电离常数${{K}_{\text{a}}}={{10}^{-1.89}}$,则丙炔酸根离子在溶液中的水解常数${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a}}}}=\dfrac{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-14}}}{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-1.89}}}={{10}^{-12.11}}$,丙酸的电离常数${{K}_{\text{a}}}={{10}^{-4.87}}$,则丙酸根离子在溶液中的水解常数${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a}}}}=\dfrac{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-14}}}{\text{1}\text{.0}\times \text{1}{{\text{0}}^{-4.87}}}={{10}^{-9.13}}$, 则$\rm a$点等浓度的丙炔酸的电离程度大于$\rm c$点丙酸的电离程度、丙炔酸根离子的水解程度小于$\rm c$点丙酸根离子的水解程度,所以$\rm a$点丙炔酸根离子的浓度大于$\rm c$点丙酸根离子的浓度,个$\rm C$正确;
$\rm D$.由图可知,$\rm d$点为丙炔酸和丙炔酸钠的混合溶液,则由电荷守恒关系$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( \text{HC}\equiv \text{CCO}{{\text{O}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$可知,溶液中$c\left( {{\text{H}}^{+}} \right)\lt c\left( \text{HC}\equiv \text{CCO}{{\text{O}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,故$\rm D$错误;
故选:$\rm C$
高中 | 盐类水解常数题目答案及解析(完整版)
