高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
硫及其化合物在生活、生产中有着广泛的应用,请回答。
关于$\rm VIA$族元素有关微粒的描述,下列说法正确的是 。
$\rm A$.第二电离能:基态氧原子高于基态氮原子
$\rm B$.$\rm \text{S}{{\text{e}}^{4+}}$的电子排布为$\rm \left[ \text{Ar} \right]4{{\text{s}}^{2}}$
$\rm C$.酸性:$\rm \text{C}{{\text{H}}_{3}}\text{OH}\lt \text{C}{{\text{H}}_{3}}\text{SH}$
$\rm D$.价电子排布图为![]() 的$\rm S$原子处于激发态
的$\rm S$原子处于激发态
$\\rm AC$
"]]$\rm A$.氧元素的原子序数为$\rm 8$,基态原子失去$\rm 1$个电子后得到$\rm O^{+}$的价电子排布式为$\rm 2s^{2}2p^{3}$,$\rm 2p$轨道为稳定的半充满结构,较难失去电子,氮元素的原子序数为$\rm 7$,基态原子失去$\rm 1$个电子后得到$\rm N^{+}$的价电子排布式为$\rm 2s^{2}2p^{2}$,较易失去电子,所以基态氧原子第二电离能高于基态氮原子,故正确;
$\rm B$.硒元素的原子序数为$\rm 34$,基态$\rm \text{S}{{\text{e}}^{4+}}$离子的电子排布为$\rm \left[ \text{Ar} \right]\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{2}}}$,故错误;
$\rm C$.氧元素的电负性大于硫元素,则甲硫醇分子中巯基的极性弱于甲醇分子中羟基的极性,解离出氢离子能力强于甲醇,酸性强于甲醇,故正确;
$\rm D$.由价电子排布图可知,![]() 表示处于基态的硫原子,故错误;
表示处于基态的硫原子,故错误;
某化合物的晶胞如图:
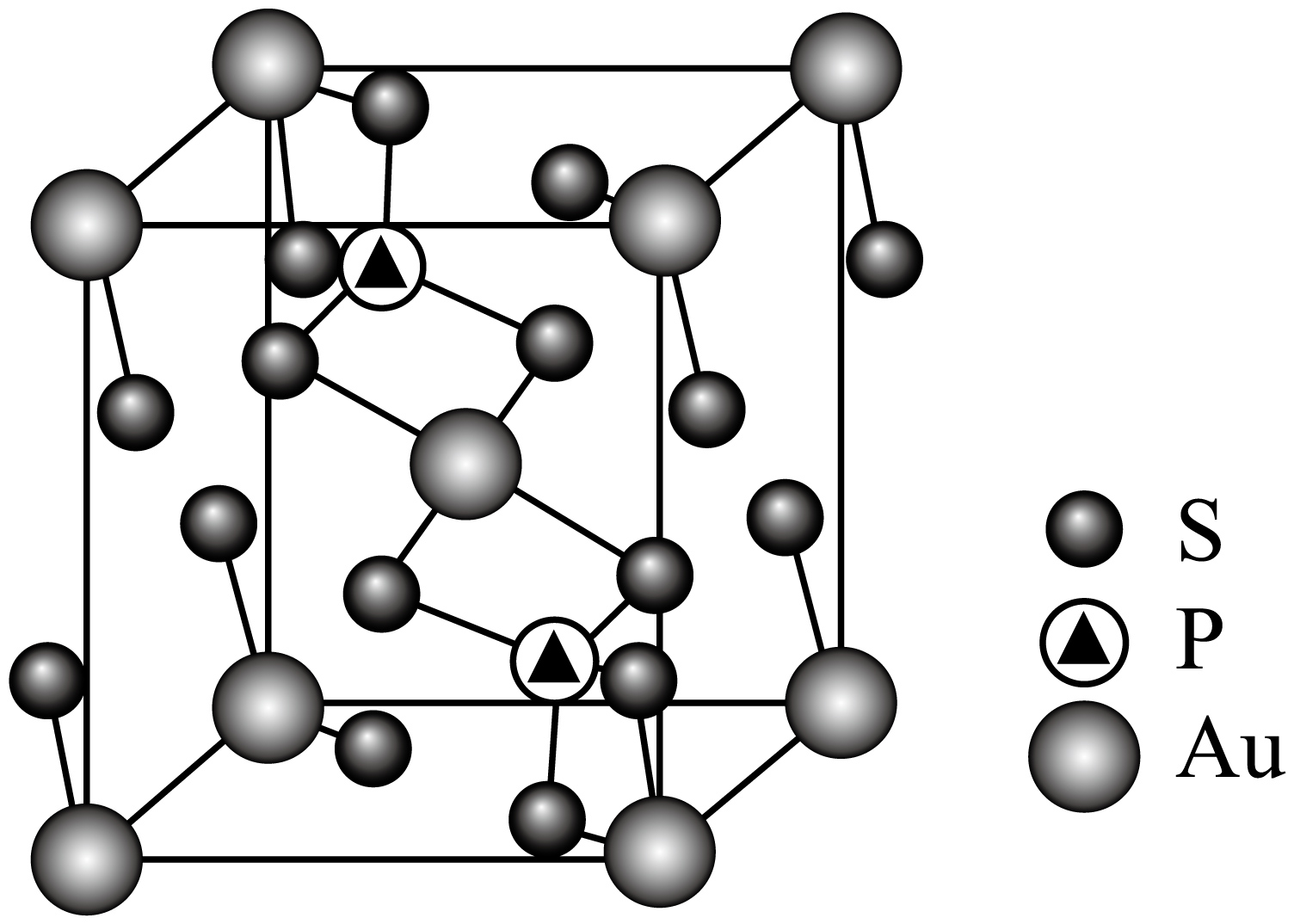
化学式是 ;距离晶胞顶点$\rm Au$原子距离最近的$\rm S$原子有 个。
$\\text{AuP}{{\\text{S}}_{4}}$ ; $\\rm 4$
"]]由晶胞结构可知,晶胞中位于顶点和体心的金原子个数为$\rm 8\times \dfrac{1}{8}\rm +1=2$,位于体内的磷原子个数为$\rm 2$,位于面上的硫原子个数为$\rm 16\times \dfrac{1}{2}\rm =8$,则晶胞的化学式为$\text{AuP}{{\text{S}}_{4}}$;晶胞中距离晶胞顶点金原子距离最近的硫原子位于面上,共有$\rm 4$个;
焦亚硫酸钠$\rm ($可视为$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}\cdot \text{S}{{\text{O}}_{2}}\rm )$溶于水所得溶液呈 $\rm ($填“酸”或“碱”$\rm )$性,结合数据说明原因 。$\rm ($常温下,${{\text{H}}_{2}}\text{S}{{\text{O}}_{3}}$的${{K}_{\text{a1}}}=1.54\times {{10}^{-2}}$,${{K}_{\text{a}2}}=1.02\times {{10}^{-7}}\rm )$
酸性 ; 焦亚硫酸钠与水发生反应:$\\text{N}{{\\text{a}}_{2}}{{\\text{S}}_{2}}{{\\text{O}}_{5}}+{{\\text{H}}_{2}}\\text{O}=\\text{NaHS}{{\\text{O}}_{3}}$,水解常数${{K}_{\\text{h}}}=\\dfrac{{{K}_{\\text{w}}}}{{{K}_{\\text{a1}}}}=6.5\\times {{10}^{-13}}\\lt {{K}_{\\text{a}2}}$
"]]焦亚硫酸钠溶于水发生的反应为:$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{5}}+{{\text{H}}_{2}}\text{O}=\text{NaHS}{{\text{O}}_{3}}$,则焦亚硫酸钠溶于水得到亚硫酸氢钠溶液,亚硫酸氢根离子的水解常数${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a1}}}}=6.5\times {{10}^{-13}}\lt {{K}_{\text{a}2}}$,所以亚硫酸氢钠溶液呈酸性;
某兴趣小组将载金硫化矿粉$\rm ($细小的$\rm Au$颗粒被$\text{Fe}{{\text{S}}_{2}}$、$\rm FeAsS$包裹$\rm )$通入空气焙烧,得到烟气和烧渣$\rm ($含有$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$和$\rm Au)$,以烧渣为原料,制备单质$\rm Au$和$\text{FeS}{{\text{O}}_{4}}\cdot 7{{\text{H}}_{2}}\text{O}$,流程如下:
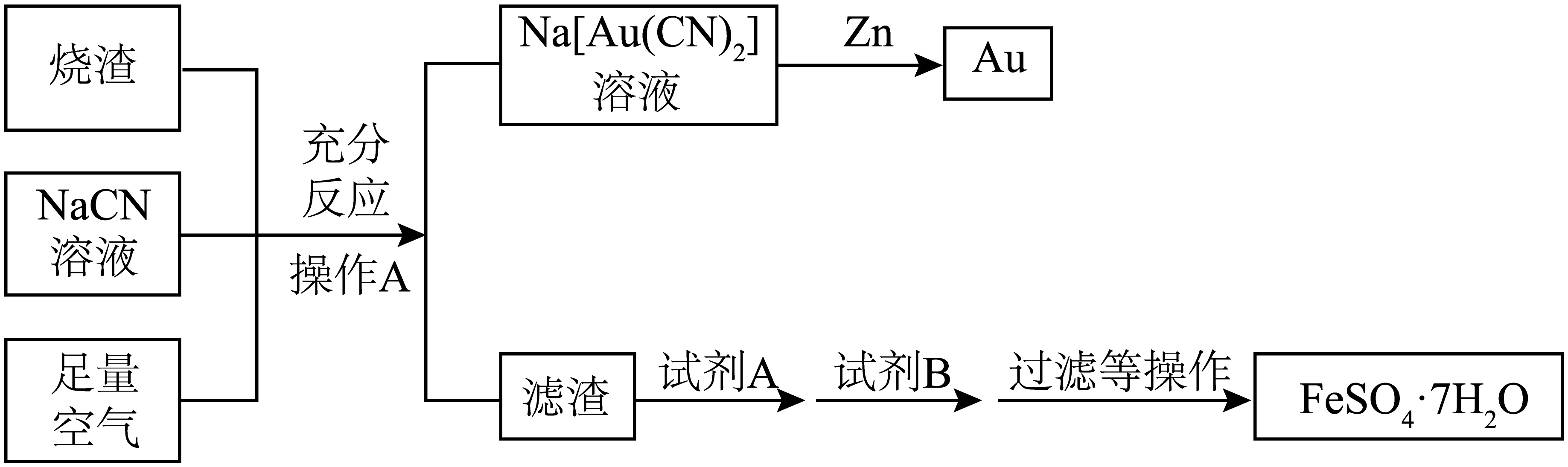
①操作$\rm A$是 ,试剂$\rm B$是 。
②写出$\rm Zn$和$\text{Na}\left[ \text{Au}{{\left( \text{CN} \right)}_{2}} \right]$生成$\rm Au$的化学方程式$\rm (Zn$元素以四配位离子存在$\rm )$ 。
③在碱性条件下,$\rm FeAsS$与足量高压${{\text{O}}_{2}}$反应,可得$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$和两种空间构型相同的酸根离子,写出反应的离子方程式 。
过滤 ; 过量铁粉 ; $\\text{Zn}+2\\text{Na}\\left[ \\text{Au}{{\\left( \\text{CN} \\right)}_{2}} \\right]=\\text{N}{{\\text{a}}_{2}}\\left[ \\text{Zn}{{\\left( \\text{CN} \\right)}_{4}} \\right]+2\\text{Au}$ ; $2\\text{FeAsS}+10\\text{O}{{\\text{H}}^{-}}+7{{\\text{O}}_{2}}=\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}+2\\text{AsO}_{4}^{3-}+2\\text{SO}_{4}^{2-}+5{{\\text{H}}_{2}}\\text{O}$
"]]由题给流程可知,含有氧化铁、金的烧渣与氰化钠溶液和足量空气反应后,过滤得到二氰合金酸钠溶液和含有氧化铁的滤渣;二氰合金酸钠溶液与锌反应后,过滤得到金和四氰合锌酸钠溶液;将滤渣溶于稀硫酸后,加入过量铁粉充分反应后,过滤得到硫酸亚铁溶液,硫酸亚铁溶液经蒸发浓缩、冷却结晶等操作得到七水硫酸亚铁;
①由分析可知,操作$\rm A$是过滤、试剂$\rm B$是过量铁粉,故答案为:过滤;过量铁粉;
②由分析可知,二氰合金酸钠溶液与锌反应生成金和四氰合锌酸钠溶液,反应的化学方程式为$\text{Zn}+2\text{Na}\left[ \text{Au}{{\left( \text{CN} \right)}_{2}} \right]=\text{N}{{\text{a}}_{2}}\left[ \text{Zn}{{\left( \text{CN} \right)}_{4}} \right]+2\text{Au}$。
高中 | 盐类水解常数题目答案及解析(完整版)
