高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
$\text{Fe}$单质及其化合物应用广泛。回答下列问题:
在元素周期表中,$\text{Fe}$位于第 周期 族。基态$\text{Fe}$原子与基态$\text{F}{{\text{e}}^{3+}}$离子未成对电子数之比为 。
四;$\\rm VIII$;$\\rm 4: 5$
"]]$\rm Fe$为$\rm 26$号元素,位于元素周期表中第四周期$\rm VIII$族;基态$\rm Fe$原子电子排布式为$\rm [Ar]3d^{6}4s^{2}$,未成对电子数为$\rm 4$,基态$\rm Fe^{3+}$电子排布式为$\rm [Ar]3d^{5}$,未成对电子数为$\rm 5$;
尿素分子$\left( {{\text{H}}_{2}}\text{NCON}{{\text{H}}_{2}} \right)$与$\text{F}{{\text{e}}^{3+}}$形成配离子的硝酸盐$\left[ \text{Fe}{{\left( {{\text{H}}_{2}}\text{NCON}{{\text{H}}_{2}} \right)}_{6}} \right]{{\left( \text{N}{{\text{O}}_{3}} \right)}_{3}}$俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素$\rm C$、$\rm N$、$\rm O$中,第一电离能最大的是 ,电负性最大的是 。
②尿素分子中,$\rm C$原子采取的轨道杂化方式为 。
③八面体配离子${{\left[ \text{Fe}{{\left( {{\text{H}}_{2}}\text{NCON}{{\text{H}}_{2}} \right)}_{6}} \right]}^{3+}}$中$\text{F}{{\text{e}}^{3+}}$的配位数为$\rm 6$,碳氮键的键长均相等,则与$\text{F}{{\text{e}}^{3+}}$配位的原子是 $\rm ($填元素符号$\rm )$。
$\\rm N$;$\\rm O$;$\\rm sp^{2}$;$\\rm O$
"]]①同周期元素从左到右,第一电离能呈增大趋势,但$\rm N$原子$\rm 2p$轨道为半充满稳定结构,第一电离能:$\rm N\gt O\gt C$;同周期元素从左到右,电负性逐渐增大,因此电负性:$\rm O\gt N\gt C$;
②尿素分子$\left( {{\text{H}}_{2}}\text{NCON}{{\text{H}}_{2}} \right)$中$\rm C$原子形成$\rm 3$个$\rm \sigma$键,无孤电子对,采取的轨道杂化方式为$\rm sp^{2}$杂化。
③八面体配离子${{\left[ \text{Fe}{{\left( {{\text{H}}_{2}}\text{NCON}{{\text{H}}_{2}} \right)}_{6}} \right]}^{3+}}$中$\text{F}{{\text{e}}^{3+}}$的配位数为$\rm 6$,碳氮键的键长均相等,因此$\rm N$原子不会参与形成配位键,说明$\rm C=O$中$\rm O$原子参与配位,所以与$\text{F}{{\text{e}}^{3+}}$配位的原子是$\rm O$。
$\alpha -\text{Fe}$可用作合成氨催化剂、其体心立方晶胞如图所示$\rm ($晶胞边长为$ {a\;\rm pm} )$。
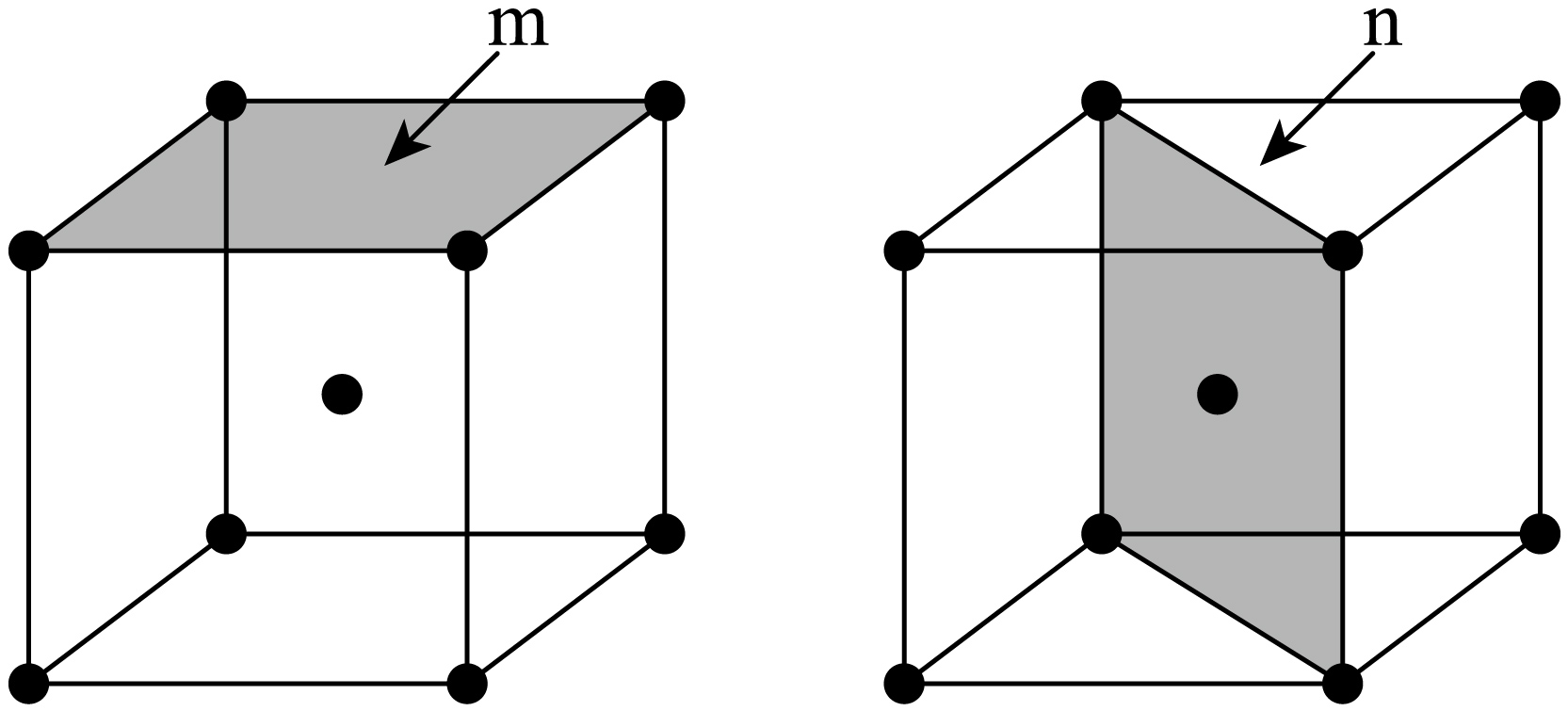
①$\rm \alpha-\text{Fe}$晶胞中$\rm \text{Fe}$原子的半径为 $\rm pm$。
②研究发现,$\rm \alpha-\text{Fe}$晶胞中阴影所示$\rm m$,$\rm n$两个截面的催化活性不同,截面单位面积含有$\rm \text{Fe}$原子个数越多,催化活性越低。$\rm m$,$\rm n$截面中,催化活性较低的是 ,该截面单位面积含有的$\rm \text{Fe}$原子为 个$\rm \cdot \text{p}{{\text{m}}^{-2}}$。
$\\dfrac{\\sqrt{3}{a}}{4}$;$\\rm n$;$\\dfrac{3\\sqrt{2}}{{4}{{{a}}^{2}}}$
"]]①$\alpha -{Fe}$为体心立方晶胞,晶胞边长为$a\;\rm pm$,体对角线长度为$\sqrt{3}{a\;\rm pm}$,体心立方晶胞中$\rm Fe$原子半径$ r$与体对角线关系为$ 4r=\sqrt{3}{a}$,因此$\rm {Fe}$原子的半径为$\dfrac{\sqrt{3}{a}}{4}\;\rm {pm}$。
②$\rm m$截面面积$S_{\rm m}=a^{2}\;\rm pm^{2}$,每个顶点被 $\rm 8$个相邻晶胞共享,每个晶胞的顶点原子贡献$\dfrac{1}{8}$个原子给该晶面,所含原子数为$4\times \dfrac{1}{8}=0.5$,单位面积原子数为$\dfrac{1}{{2}{{{a}}^{2}}}$个$\rm pm^{-2}$;$\rm n$截面面积为${a}\times \sqrt{2}{a}=\sqrt{2}{{{a}}^{2}}\;\rm pm^{2}$,每个顶点被$\rm 8$个相邻晶胞共享,体心原子完全属于本截面,所含原子数为$\left( 4\times \dfrac{1}{8} \right)+1=1.5$,单位面积原子数为$\dfrac{3}{2\sqrt{2}{{{a}}^{2}}}=\dfrac{3\sqrt{2}}{{4}{{{a}}^{2}}}$个∙$\rm pm^{-2}$,因此催化活性较低的是$\rm n$截面,该截面单位面积含有的$\rm {Fe}$原子为$\dfrac{3\sqrt{2}}{{4}{{{a}}^{2}}}$个∙$\rm pm^{-2}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
