高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
现有甲、乙、丙三种吡啶$\rm ($![]() $\rm )$的衍生物,其结构如图所示。
$\rm )$的衍生物,其结构如图所示。
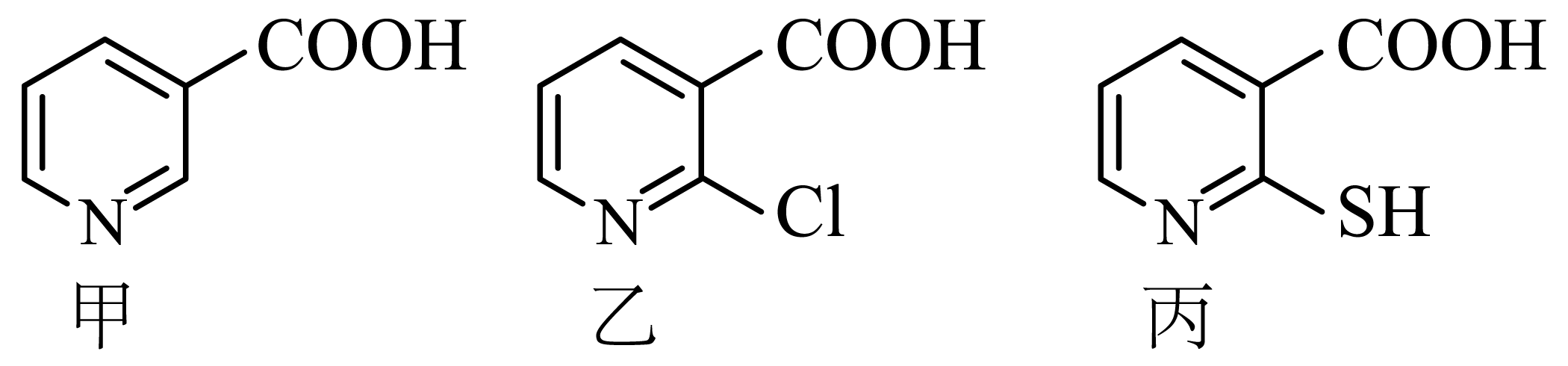
下列说法正确的是$(\quad\ \ \ \ )$
第一电离能:$\\text{O}\\gt \\text{N}\\gt \\text{S}$
","共价键的极性:丙中$\\text{C}-\\text{S}\\gt $中$\\text{C}-\\text{Cl}$
","$-\\text{COOH}$的电离常数$K_{\\mathrm{a}}$:甲$\\rm \\gt $乙
","丙中$\\text{O}-\\text{C}=\\text{O}$键角大于$\\text{C}-\\text{S}-\\text{H}$键角
"]$\rm A$.第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所需吸收的最低能量,$\rm N$原子$\rm 2p$轨道半充满,$\rm N$比相邻的$\rm O$原子更稳定,$\rm N$比$\rm O$更难失电子,$\rm O$、$\rm S$同主族,$\rm S$原子半径大于$\rm O$原子,$\rm S$比$\rm O$更易失去电子,所以因此第一电离能:$\text{N}\gt \text{O}\gt \text{S}$,故$\rm A$错误;
$\rm B$.同周期元素从左到右电负性能增大,即$\text{S}\lt \text{Cl}$,则丙中$\text{C}-\text{S}$小于乙中$\text{C}-\text{Cl}$电负性差值,则共价键的极性:丙中$\text{C}-\text{S}$小于乙中$\text{C}-\text{Cl}$,故$\rm B$错误;
$\rm C$.乙比甲在羧基的邻位上多了一个氯原子,氯原子具有很强的吸电子能力,会使乙中羧酸容易电离出氢离子,酸性更强,所以$K_{\rm a}$:甲$\rm \lt $乙,故$\rm C$错误;
$\rm D$.$\text{O}-\text{C}=\text{O}$中$\rm C$是$\mathrm{sp}^2$杂化,$\text{C}-\text{S}-\text{H}$中$\rm S$是$\text{s}{{\text{p}}^{3}}$杂化,所以丙中$\text{O}-\text{C}=\text{O}$键角大于$\text{C}-\text{S}-\text{H}$键角,故$\rm D$正确;
故选:$\rm D$
高中 | 杂化轨道理论题目答案及解析(完整版)
