高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
稀土元素作为现代工业和科技发展中不可或缺的关键元素,其提取与利用一直是材料科学和工程领域的重要研究方向。以下是一种以氟碳铈矿$\rm ($主要成分为$\text{CeFC}{{\text{O}}_{3}}$和$\text{LaFC}{{\text{O}}_{3}}$,同时含有$\text{Fe}、\text{Al}、\text{Pb}$等杂质元素$\rm )$为原料湿法提取稀土元素$\text{Ce}$和$\text{La}$的工艺流程图。
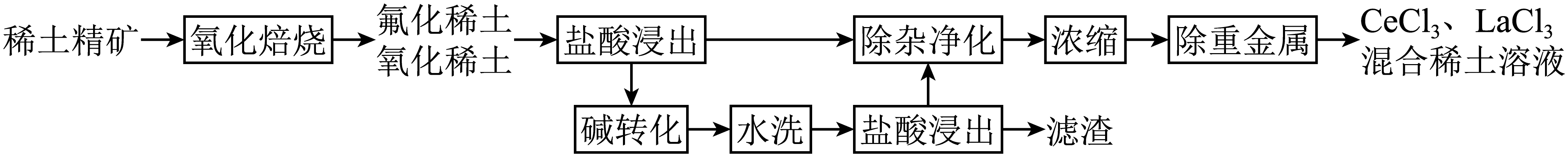
已知:①氟化稀土难溶于水,且不易被氧化。
②$\rm Ce$元素有$\rm +3$和$\rm +4$价,且$\rm +4$价$\rm Ce$元素具有强氧化性。
③${{K}_{\text{sp}}}\left[ \text{Ce}{{\left( \text{OH} \right)}_{3}} \right]={{10}^{-19.7}}\,$、${{K}_{\text{sp}}}\left[ \text{La}{{\left( \text{OH} \right)}_{3}} \right]={{10}^{-18.8}}$。
$\rm La$为$\rm 57$号元素,价层电子排布与$\rm 21$号元素类似,则其价层电子排布式为 ,位于周期表 区。
$5\\ {{\\text{d}}^{1}}6\\ {{\\text{s}}^{2}}$ ; $\\rm f$
"]]$\rm 21$号元素得价层电子排布式为$\rm 3d^{1}4s^{2}$,$\rm La$为$\rm 57$号元素,位于第六周期,价层电子排布与$\rm 21$号元素类似,则其价层电子排布式为$\rm 5d^{1}6s^{2}$,位于周期表$\rm f$区。
“氧化焙烧”过程中$\text{CeFC}{{\text{O}}_{3}}$发生反应的化学方程式为 。
$6\\text{CeFC}{{\\text{O}}_{3}}+{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{焙烧}} \\\\ {} \\\\\\end{matrix}2\\text{Ce}{{\\text{F}}_{3}}+4\\text{Ce}{{\\text{O}}_{2}}+6\\text{C}{{\\text{O}}_{2}}$
"]]$\rm Ce$元素有$\rm +3$和$\rm +4$价,且$\rm +4$价$\rm Ce$元素具有强氧化性,氟化稀土难溶于水,且不易被氧化,“氧化焙烧”过程中得到氟化稀土、氧化稀土,则$\text{CeFC}{{\text{O}}_{3}}$与氧气反应生成$\rm CeF_{3}$、$\rm CeO_{2}$和$\rm CO_{2}$,发生反应的化学方程式为$6\text{CeFC}{{\text{O}}_{3}}+{{\text{O}}_{2}}\begin{matrix} \underline{\underline{焙烧}} \\ {} \\\end{matrix}2\text{Ce}{{\text{F}}_{3}}+4\text{Ce}{{\text{O}}_{2}}+6\text{C}{{\text{O}}_{2}}$。
第一次盐酸浸出时产生的一种污染性气体为 $\rm ($写名称$\rm )$,写出该气体的一种工业用途 。
氯气 ; 作漂白剂的原料或工业制盐酸等$\\rm ($答案合理$\\rm )$
"]]$\rm +4$价$\rm Ce$元素具有强氧化性,第一次盐酸浸出时,$\rm CeO_{2}$把$\rm HCl$氧化为氯气,产生的污染性气体为氯气,氯气在工业上用作漂白剂的原料或工业制盐酸等。
“除杂净化”过程中,通过加入$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液调节$\text{pH}$除去铁、铝离子,写出除铁离子的离子方程式 。
$3\\text{CO}_{3}^{2-}+2\\text{F}{{\\text{e}}^{3+}}+3{{\\text{H}}_{2}}\\text{O}=2\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +3\\text{C}{{\\text{O}}_{2}}\\uparrow $
"]]“除杂净化”过程中,加入$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液调节$\text{pH}$除去铁、铝离子,碳酸根离子和$\rm Fe^{3+}$发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为$3\text{CO}_{3}^{2-}+2\text{F}{{\text{e}}^{3+}}+3{{\text{H}}_{2}}\text{O}=2\text{Fe}{{\left( \text{OH} \right)}_{3}}\downarrow +3\text{C}{{\text{O}}_{2}}\uparrow $。
“碱转化”过程中需调节$\text{pH}$不小于 ,才能确保转化完全$\rm ($离子浓度低于${{10}^{-5}}\,\text{mol}/\text{L}$认为已转化完全$\rm )$。
$\\rm 9.4$
"]]根据${{K}_{\text{sp}}}\left[ \text{Ce}{{\left( \text{OH} \right)}_{3}} \right]={{10}^{-19.7}}\ $、${{K}_{\text{sp}}}\left[ \text{La}{{\left( \text{OH} \right)}_{3}} \right]={{10}^{-18.8}}$,$\rm Ce(OH)_{3}$更易沉淀,当$\rm La^{3+}$浓度小于${{10}^{-5}}\,\text{mol}/\text{L}$时, $c\left( \text{O}{{\text{H}}^{-}} \right)\gt \sqrt[3]{\dfrac{{{10}^{-18.8}}}{{{10}^{-5}}}}={{10}^{-4.6}}\,\text{mol/L}$, $c\left( {{\text{H}}^{+}} \right)\lt {{10}^{-9.4}}\,\text{mol/L}$“碱转化”过程中需调节$\text{pH}$不小于$\rm 9.4$,才能确保转化完全。
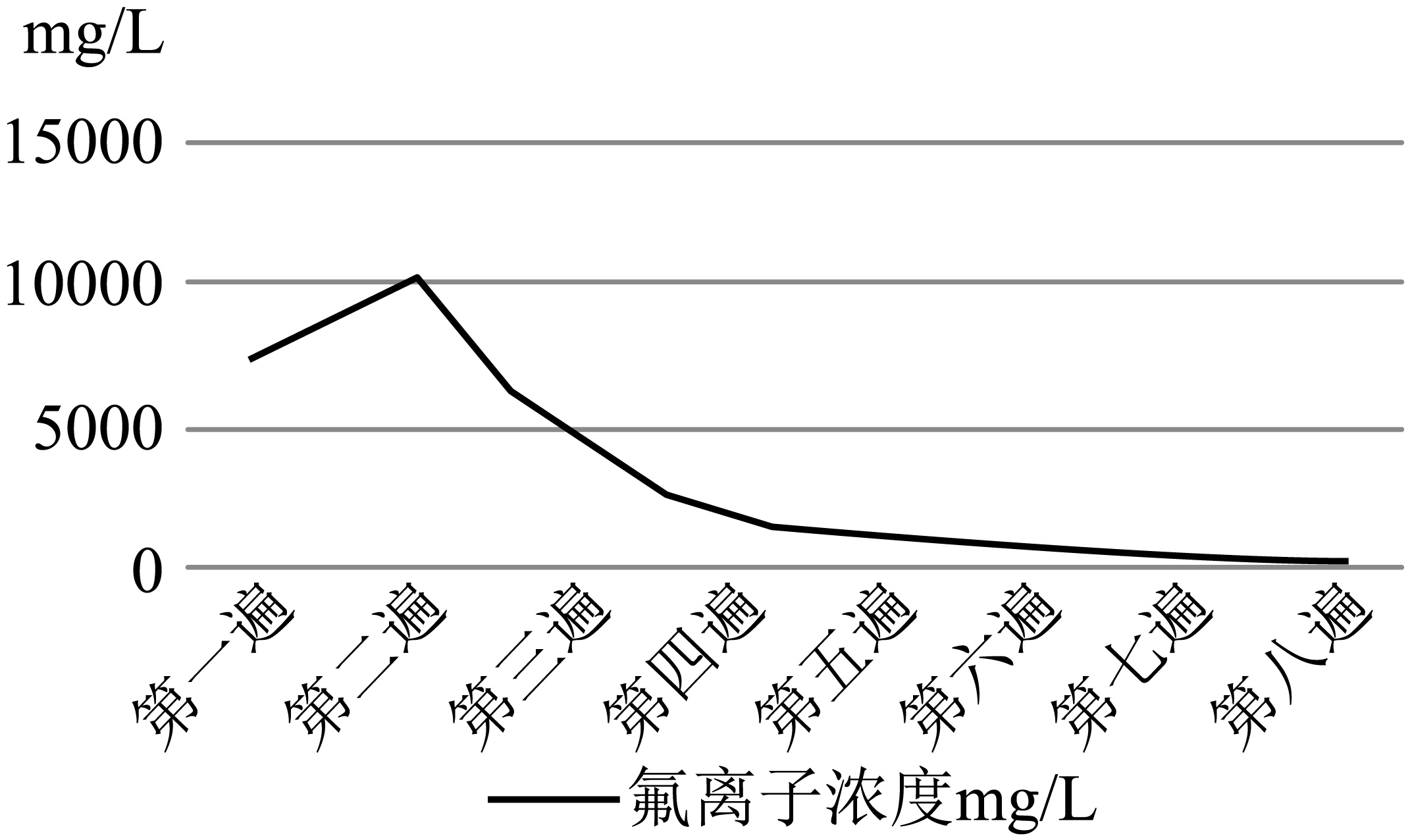
下图是水洗过程中水洗次数与洗水中氟离子浓度走势图,实际生产中选择在第四次水洗后加入$\text{CaC}{{\text{l}}_{2}}$粉末完成除氟,原因是 。
简化了水洗的步骤,节约了水资源;减少了$\\text{CaC}{{\\text{l}}_{2}}$的用量
"]]根据图示,第四次水洗后,氟离子浓度变化不大,实际生产中选择在第四次水洗后加入$\text{CaC}{{\text{l}}_{2}}$粉末完成除氟,简化了水洗的步骤,节约了水资源;减少了$\text{CaC}{{\text{l}}_{2}}$的用量。
高中 | 氯气题目答案及解析(完整版)
