高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
某研究小组利用次氯酸钠和硝酸铁溶液反应生成的高铁酸钠$\rm (Na_{2}FeO_{4})$制备新型绿色消毒剂高铁酸钾$\rm (K_{2}FeO_{4})$,按如下流程开展实验。
用以下装置完成上述反应$\rm I$和反应Ⅱ:
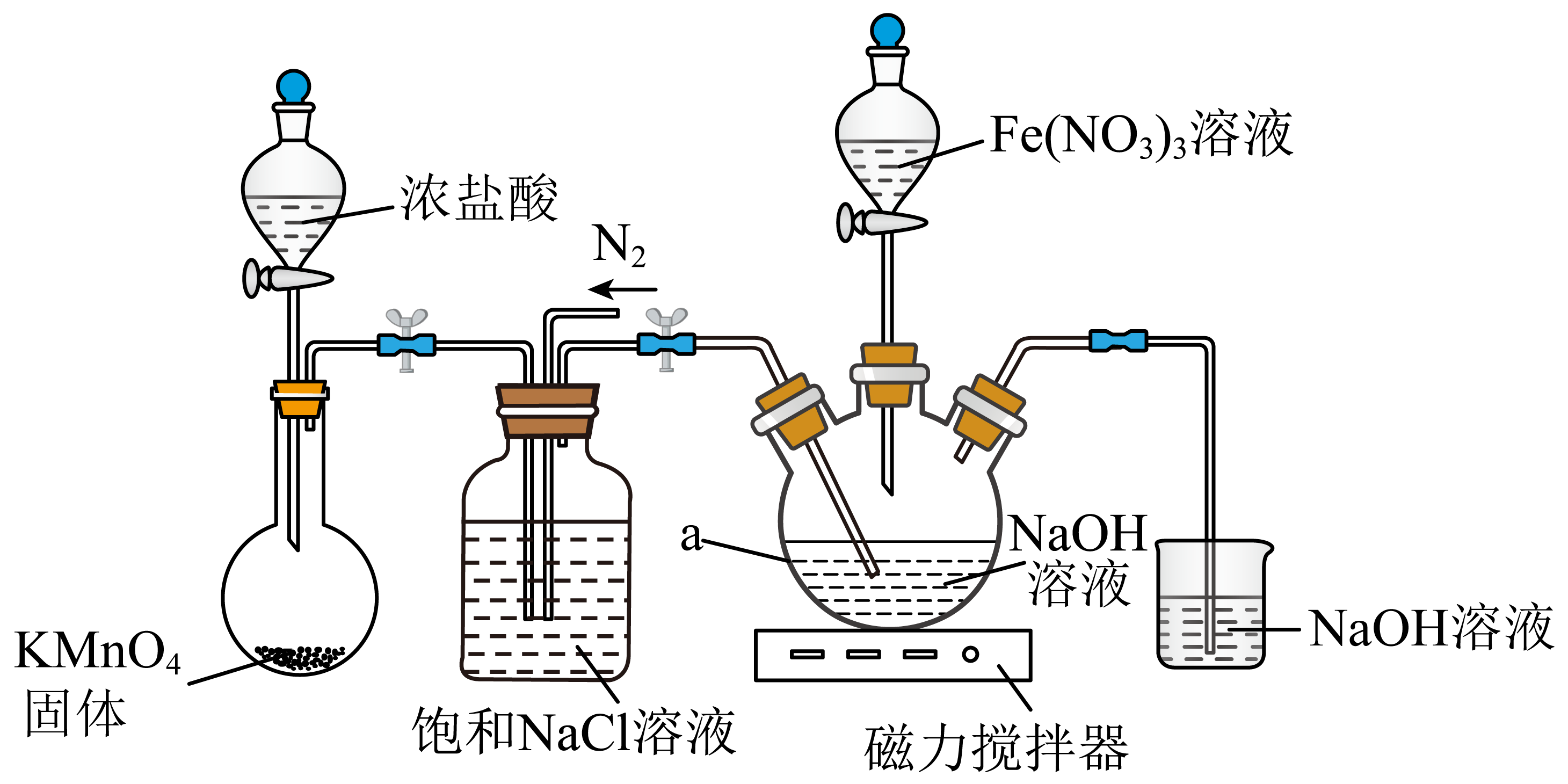
已知:$\rm K_{2}FeO_{4}$易溶于水,在浓$\rm KOH$溶液中溶解度小;在酸性和碱性条件下都具有强氧化性,且氧化性强于酸性高锰酸钾溶液;在$\rm 0$~$\rm 5\;\rm ^\circ\rm C$碱性溶液中较稳定,在酸性或中性溶液中快速产生$\rm O_{2.}$
盛有$\rm KMnO_{4}$固体的仪器名称 ;饱和$\rm NaCl$溶液的作用 。
圆底烧瓶 除去$\\rm Cl_{2}$中混有的$\\rm HCl$
"]]盛有$\text{KMn}{{\text{O}}_{4}}$固体的仪器名称圆底烧瓶;由分析可知,饱和$\rm NaCl$溶液的作用除去$\text{C}{{\text{l}}_{2}}$中混有得$HCl$;
反应$\rm I$的离子方程式 。
$\\rm Cl_{2}+2OH^{-}=Cl^{-}+ClO^{-}+H_{2}O$
"]]由分析可知,反应$\rm I$为$2NaOH+C{{l}_{2}}\text{NaCl}+NaClO+{{\text{H}}_{2}}$,则离子方程式为:$2O{{H}^{-}}+C{{l}_{2}}\text{C}{{\text{l}}^{-}}+Cl{{O}^{-}}+{{\text{H}}_{2}}\text{O}$;
下列说法正确的是$(\quad\ \ \ \ )$。
反应$\\rm I$和反应$\\rm II$均在$a$仪器中进行
","反应$\\rm II$结束后应通一段时间$\\rm N_{2}$,然后再拆下装置进行后续实验
","加入饱和$\\rm KOH$溶液进行转化时,发生氧化还原反应
","可用$\\rm FeCl_{3}$溶液代替$\\rm Fe(NO_{3})_{3}$溶液
"]$\rm A$.由分析可知,反应$\rm I$和反应$\rm II$均在$a$仪器三颈烧瓶中进行,$\rm A$正确;
$\rm B$.反应$\rm II$结束后应通一段时间${{\text{N}}_{\text{2}}}$,目的是将装置中得氯气全部导入氢氧化钠溶液中进行吸收,防止污染空气,然后再拆下装置进行后续实验,$\rm B$正确;
$\rm C$.由分析可知,加入饱和$KOH$溶液进行转化,目的是将$N{{a}_{2}}Fe{{O}_{4}}$转化为${{\text{K}}_{2}}Fe{{O}_{4}}$,发生的是复分解反应,$\rm C$错误;
$\rm D$.若用$\text{FeC}{{\text{l}}_{\text{3}}}$溶液代替$Fe{{\left( N{{O}_{3}} \right)}_{3}}$溶液,${{\text{K}}_{2}}Fe{{O}_{4}}$的产率和纯度都会降低,一个原因是在反应温度和强碱环境下$\text{NaCl}$的溶解度比$\text{NaN}{{\text{O}}_{\text{3}}}$大,使得$\text{NaCl}$结晶去除率较低,另一个原因是${{\text{K}}_{2}}Fe{{O}_{4}}$具有强氧化性,能将氯离子氧化,消耗产品使得产率降低,$\rm D$错误;
答案选$\rm AB$。
高铁酸钾既能消毒又能净水,其原因是 。
高铁酸钾具有强氧化性,可杀菌消毒;同时生成氢氧化铁胶体,可以净水
"]]根据已知信息,${{\text{K}}_{2}}Fe{{O}_{4}}$具有强氧化性,且氧化性强于酸性高锰酸钾溶液,则高铁酸钾既能消毒又能净水的原因是:铁酸钾具有强氧化性,可杀菌消毒;同时生成氢氧化铁胶体,可以净水;
为提高纯度,需对粗产品进行重结晶操作,从下列选项中选出合理的操作步骤: 。
$\rm →$过滤取滤液$\rm →$加入饱和$\rm KOH$溶液$\rm →$置于冰水浴中$\rm →→$洗涤、干燥$\rm →$得产品
$a$.将粗产品溶于热水
$b$.将粗产品溶于冷的稀$\rm KOH$溶液
$c$.过滤取沉淀
$\rm d$.蒸发浓缩,趁热过滤
$\rm f$.冷却结晶
$\\rm bc$
"]]为提高纯度,需对粗产品进行重结晶操作,过滤取滤液,加入饱和$KOH$溶液,置于冰水中,过滤取沉淀,所得沉淀经乙醇洗涤、干燥,可得产品,故答案选$\rm bc$;
测定产品的纯度$\rm (K_{2}FeO_{4}$式量为$\rm M)$
向$\rm NaOH$溶液中加入固体碘化钾和氟化钠并溶解;准确称取$\rm mg$样品加入该溶液,待样品充分溶解后,加硫酸酸化至反应完全;用$\rm cmol·L^{-1}Na_{2}S_{2}O_{3}$溶液进行反应,恰好完全反应时消耗$\rm Na_{2}S_{2}O_{3}$溶液体积为$\rm vmL$。
已知:$\rm 2FeO_{\text{4}}^{\text{2-}}\rm +6I^{-}+12F^{-}+8H_{2}O=2FeF_{\text{6}}^{\text{3-}}\rm +3I_{2}+16OH^{-}$;$\rm I_{2}+2S_{2}O_{\text{3}}^{\text{2-}}\rm =2I^{-}+S_{4}O_{\text{6}}^{\text{2-}}$,实验测得$\rm K_{2}FeO_{4}$纯度为 。
$\\dfrac{\\text{0}\\text{.1cvM}}{\\text{3\\;\\rm m}}\\rm \\%$
"]]根据得失电子守恒可得关系式:$2FeO_{4}^{2-}\sim3{{\text{I}}_{2}}\sim6{{\text{S}}_{2}}\text{O}_{3}^{2-}$,则本次实验测得${{\text{K}}_{2}}Fe{{O}_{4}}$纯度为$\dfrac{cmol/\text{L}\times \text{V}\times {{10}^{-3}}\text{L}\times \dfrac{1}{3}\times Mg/mol}{mg}\times 100\%=\dfrac{0.1cVM}{3\;\rm \text{m}}\%$;
高中 | 氯气题目答案及解析(完整版)
