高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
实验室中利用下图装置$\rm ($部分装置省略$\rm )$制备$\text{KCl}{{\text{O}}_{3}}$和$\rm NaClO$,并探究其氧化还原性质:
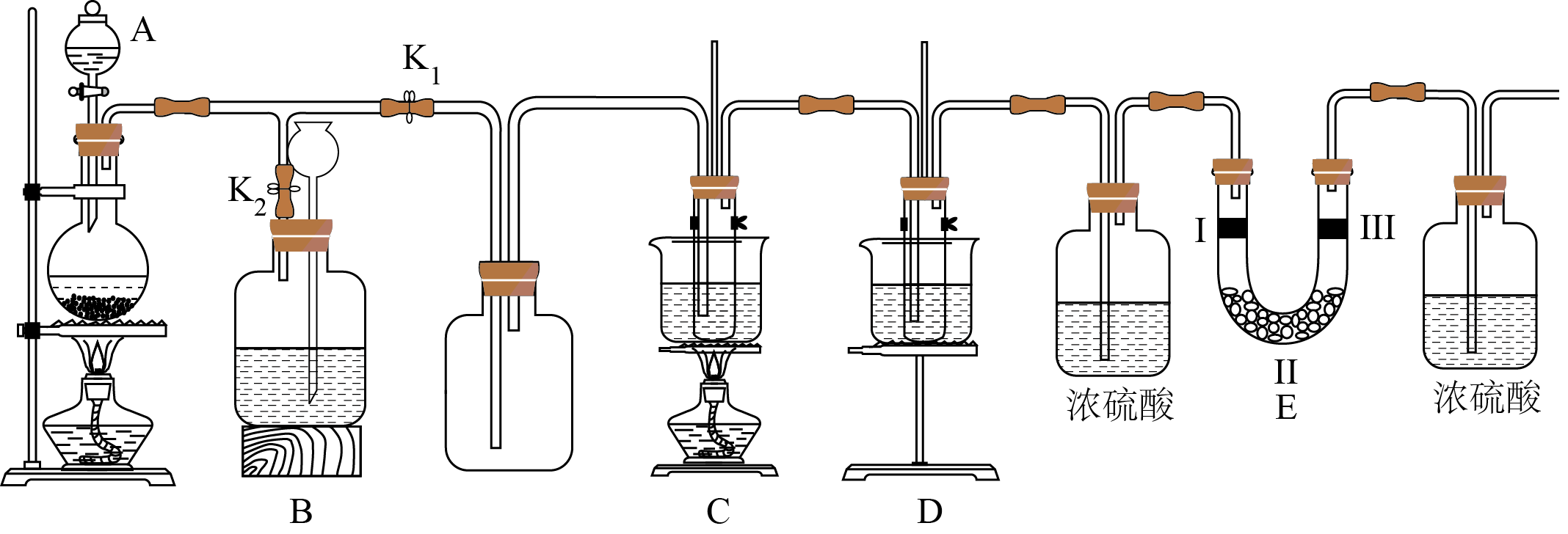
制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 $\rm ($填写仪器名称$\rm )$向烧瓶中加入适量的盐酸。
分液漏斗
"]]制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的盐酸。
装置$\rm B$可贮存多余的气体,则装置$\rm B$中所盛装的液体是 ;装置$\rm B$中长颈漏斗的作用是 。
饱和食盐水; 平衡气压
"]]$\rm Cl_{2}$在饱和食盐水中的溶解度较小,装置$\rm B$可贮存多余的气体,则装置$\rm B$中所盛装的液体是饱和食盐水,装置$\rm B$中长颈漏斗的作用是:平衡气压,防止$\rm B$中氯气过多导致压强过大。
可用$\rm C$、$\rm D$装置制取氯酸钾和次氯酸钠,图中$\rm C$装置的试管里盛有$\rm 15\;\rm mL\;\rm 30\%KOH$溶液,置于热水浴中;$\rm D$装置的试管里盛有$15\;\rm \text{mL}\rm 30\%\text{NaOH}$溶液,置于冰水浴中;比较制取氯酸钾和次氯酸钠的条件,二者的差异是 。反应完毕经冷却后,$\rm C$的试管中有大量晶体析出。图中符合该晶体溶解度曲线的是 $\rm ($填写编号字母$\rm )$;从$\rm C$的试管中分离出该晶体的方法是 $\rm ($填写实验操作名称$\rm )$。
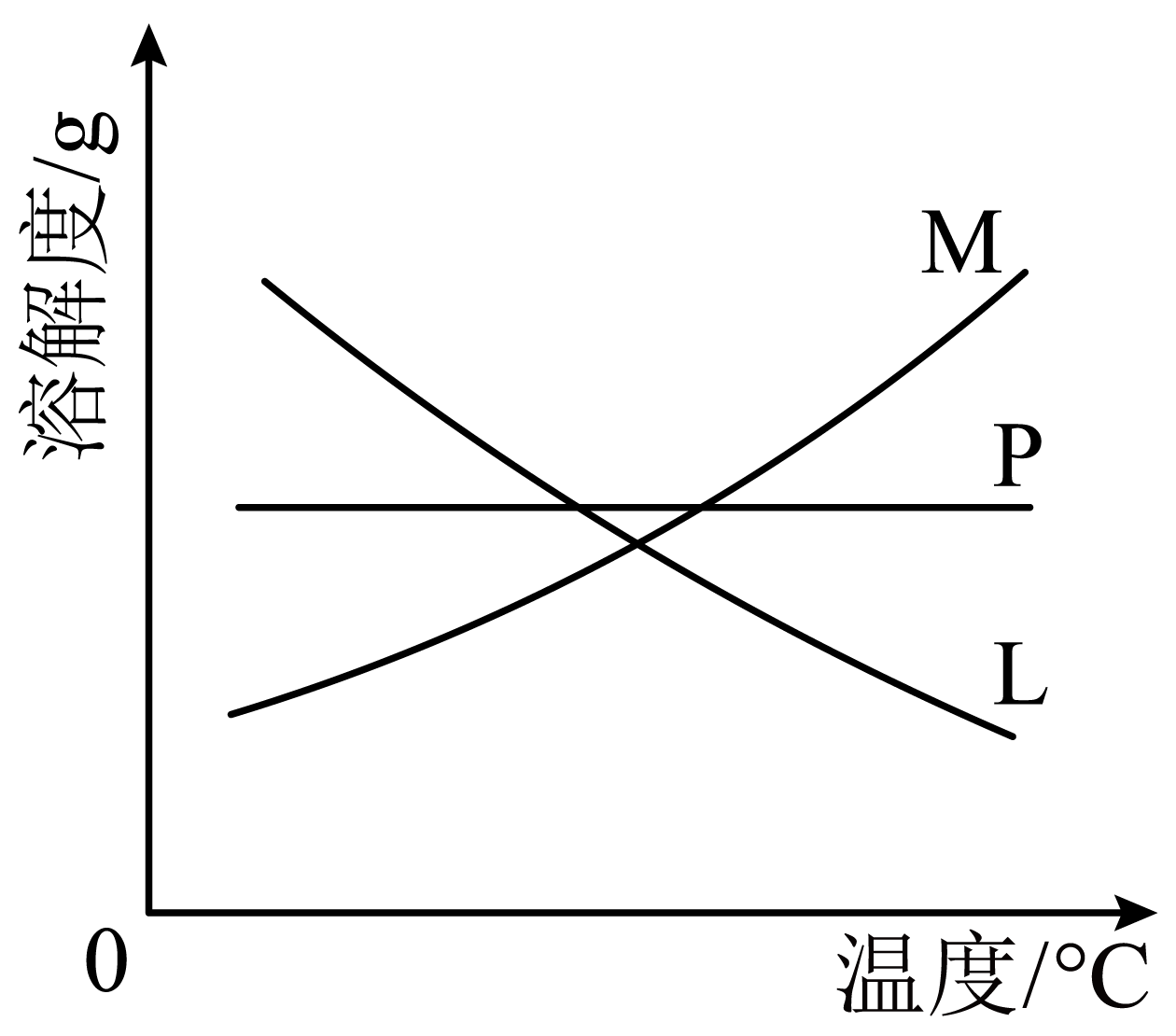
温度不同; $\\rm M$; 过滤
"]]制取氯酸钾需要加热,而制取次氯酸钠需要冰水浴,说明制取氯酸钾和次氯酸钠的条件,二者的差异是温度不同;反应完毕经冷却后,$\rm C$的试管中有大量晶体析出,说明氯酸钾溶解度受温度影响较大,且温度降低溶解度减小,图中符合该晶体溶解度曲线的是$\rm M$;过滤为分离固液的方法,从$\rm C$的试管中分离出该晶体的方法是过滤;
取少量$\text{KCl}{{\text{O}}_{3}}$和$\rm NaClO$溶液分别置于$\rm 1$号和$\rm 2$号试管中,滴加淀粉$\rm -KI$溶液。$\rm 1$号试管溶液颜色不变,$\rm 2$号试管溶液变为蓝色。由此可知,该条件下的$\text{KCl}{{\text{O}}_{3}}$氧化能力 $\rm ($填“大于”或“小于”$\rm )NaClO$,写出$\rm 2$号试管中加入淀粉$\rm -KI$溶液反应的离子方程式 。
小于; $\\rm ClO^{-}+2I^{-}+H_{2}O=I_{2}+Cl^{-}+2OH^{-}$
"]]$\rm 1$号试管溶液颜色不变,$\rm 2$号试管溶液变为蓝色,说明次氯酸钠可以将$\rm KI$氧化为$\rm I_{2}$,而氯酸钾不能将$\rm KI$氧化为$\rm I_{2}$,由此可知,该条件下氯酸钾的氧化能力小于次氯酸钠,$\rm 2$号试管中加入淀粉溶液反应的离子方程式为:$\rm ClO^{-}+2I^{-}+H_{2}O=I_{2}+Cl^{-}+2OH^{-}$。
装置$\rm E$的作用是验证氯气的漂白性,则装置中$\rm I$、Ⅱ、Ⅲ处依次应放入的物质是$(\quad\ \ \ \ )\rm ($填写编号字母$\rm )$。
干燥的石蕊试纸、碱石灰、湿润的石蕊试纸
","湿润的石蕊试纸、浓硫酸、干燥的石蕊试纸
","湿润的石蕊试纸、无水氯化钙、干燥的石蕊试纸
"]要验证氯气是否有漂白性,可以利用石蕊试纸,因为制取的氯气含有水蒸气,氯气和水生成的 $\rm HClO$ 有漂白性,先验证氯气是否能够使湿润的石蕊试纸褪色,然后用干燥氯气通过干燥的石蕊试纸检验氯气的漂白性,干燥氯气不能选用与氯气反应的碱石灰, $\rm U$ 形管一般盛装固体干燥剂,浓硫酸不能盛装在 $\rm U$ 形管中,此题可选用无水氯化钙,所以正确的选项是 $\rm C$ ;
该实验装置存在的明显缺陷是 。
缺少尾气处理装置
"]]尾气有毒,可以使用氢氧化钠溶液吸收氯气防止污染空气,缺陷为缺少尾气处理装置。
高中 | 氯气题目答案及解析(完整版)
