高中 | 离子化合物 题目答案及解析
稿件来源:高途
高中 | 离子化合物题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
离子化合物
离子液体作为一种绿色溶剂,具有熔点低等独特性能,被广泛应用于化学研究的各个领域中。某离子液体$\rm ($结构式如图$\rm )$由$\text{R}$、$\text{W}$、$\text{X}$、$\text{Y}$、$\text{Z}$五种短周期主族元素组成,它们的原子序数依次增大,$\text{Z}$原子比$\text{X}$原子多$\rm 8$个电子。
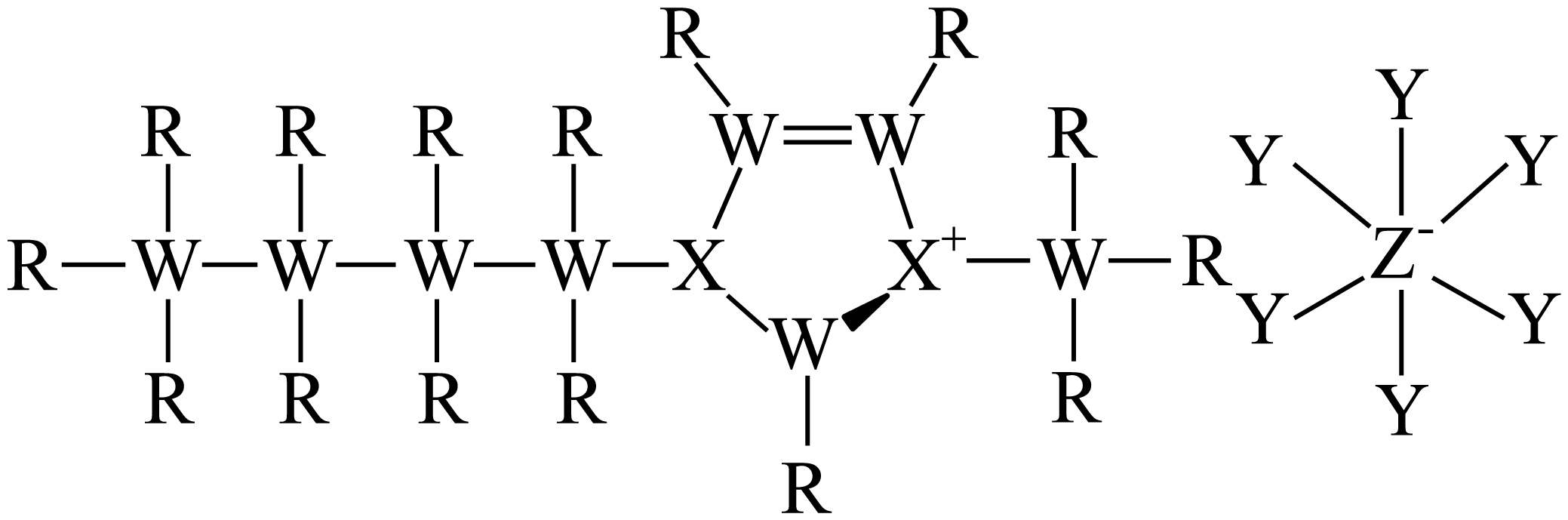
下列说法错误的是$(\quad\ \ \ \ )$
最高价含氧酸的酸性:$\\text{Y}\\gt \\text{X}$
","$\\rm R$、$\\rm X$、$\\rm Y$可形成离子化合物
","同周期元素中第一电离能小于$\\text{X}$的有$\\rm 5$种
","基态$Z$原子核外有$\\rm 15$种不同运动状态的电子
"]某离子液体$\rm ($结构式如图$\rm )$由$\text{R}$、$\text{W}$、$\text{X}$、$\text{Y}$、$\text{Z}$五种短周期主族元素组成,它们的原子序数依次增大,$\rm R$形成$\rm 1$个共价键且原子序数最小,$\rm R$为氢;$\rm W$形成$\rm 4$个共价键,为碳;$\rm X$形成$\rm 3$个共价键,为氮,$\text{Z}$原子比$\text{X}$原子多$\rm 8$个电子,$\rm Z$为磷;$\rm Y$形成$\rm 1$个共价键,则为氟;
$\rm A$.氟电负性太强,不能形成含氧酸,$\rm A$错误;
$\rm B$.$\rm R$、$\rm X$、$\rm Y$可形成离子化合物$\rm NH_{4}F$,$\rm B$正确;
$\rm C$.同一周期随着原子序数变大,第一电离能变大,$\rm N$的$\rm 2p$轨道为半充满稳定状态,第一电离能大于同周期相邻元素,同周期元素中第一电离能小于$\rm N$的有$\rm Li$、$\rm B$、$\rm Be$、$\rm C$、$\rm O$,$\rm 5$种,$\rm C$正确;
$\rm D$.在同一原子轨道下最多可以有两个自旋方向不同的电子,自旋方向不同,运动状态也就不相同,即运动状态个数等于电子数;基态$\rm P$原子核外有$\rm 15$种不同运动状态的电子,$\rm D$正确;
故选:$\rm A$
高中 | 离子化合物题目答案及解析(完整版)
