高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙醛是非常重要的化工原料,可以用来制备乙酸、乙酸乙酯等物质。工业上制备乙醛的重要方法之一是乙醇脱氢法$\rm ($反应$\rm a)$:${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)\to \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{1}}$
定义标准摩尔生成热${{\Delta }_{\text{f}}}{{H}_{{m}}}$:在标准压力$\rm (100\,\text{kPa}\rm )$下,一定温度时,由最稳定单质生成$1\,\text{mol}$物质的反应焓变。例如${{\Delta}_{\text{f}}}{{H}_{{m}}}\left( {{\text{C}}_{2}}{{\text{H}}_{2\left( \text{g} \right)}} \right)=+227\,\,\text{kJ}/\text{mol}$的物理意义可用以下反应表示。
$2\text{C}\left( \text{s} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\to {{\text{C}}_{2}}{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{2}}=+227\ \text{kJ}/\text{mol}$
相关物质的${{\Delta}_{\text{f}}}{{H}_{{m}}}\left( \text{kJ}/\text{mol} \right)$如下表所示。写出表示$\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)$标准摩尔生成热的热化学方程式: 。
| 物质 | $\text{C}\left( \text{s} \right)$ | ${{\text{H}}_{2}}\left( \text{g} \right)$ | ${{\text{O}}_{2}}\left( \text{g} \right)$ | $\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)$ | ${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)$ | ${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$ |
| ${{\Delta}_{\text{f}}}{{H}_{{m}}}$ | $\rm 0$ | $\rm 0$ | $\rm 0$ | $\rm -166$ | $\rm -235$ | $\rm -242$ |
由表中数据可知$\Delta{{H}_{1}}=$ $\;\rm \text{kJ}/\text{mol}$。
${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)\to \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$
$2\\text{C}\\left( \\text{s} \\right)+2{{\\text{H}}_{2}}\\left( \\text{g} \\right)+\\dfrac{1}{2}{{\\text{O}}_{2}}\\left( \\text{g} \\right)\\to \\text{C}{{\\text{H}}_{3}}\\text{CHO}\\left( \\text{g} \\right)\\quad \\Delta H=-166\\ \\text{kJ}/\\text{mol}$ ; $\\rm +69$
"]]根据题意,生成$\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)$需要的单质是$\text{C}\left( \text{s} \right)$、${{\text{H}}_{2}}\left( \text{g} \right)$、${{\text{O}}_{2}}\left( \text{g} \right)$,表示$\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)$标准摩尔生成热的热化学方程式:$2\text{C}\left( \text{s} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right)\to \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)\quad \Delta H=-166\ \text{kJ}/\text{mol}$;${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)\to \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-166\,\text{kJ}/\text{mol}+0\,\text{kJ}/\text{mol}-(-235\,\text{kJ}/\text{mol})=+69\,\text{kJ}/\text{mol}$;
维持反应器总压为$1.0\,\text{MPa}$,投料比$x=\dfrac{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)}{n\left( {{\text{H}}_{2}}\text{O} \right)}=1$或$\rm 2$,只发生反应$\text{a}$,水蒸气不参加反应,乙醇的平衡转化率$\alpha $随温度的变化曲线如图,$x=1$时的曲线为 ;${{T}_{1}}\text{ }{}^\circ \text{C}$时,反应$\text{a}$的平衡常数${{K}_{\text{p}}}=$ $\rm MPa$.$ ({{K}_{\text{p}}}$是以平衡分压$p\left( \text{A} \right)$代替平衡浓度$c\left( \text{A} \right)$表示的常数,$p\left( \text{A} \right)={{p}_{总}}\times \text{A}$的物质的量分数$\rm )$
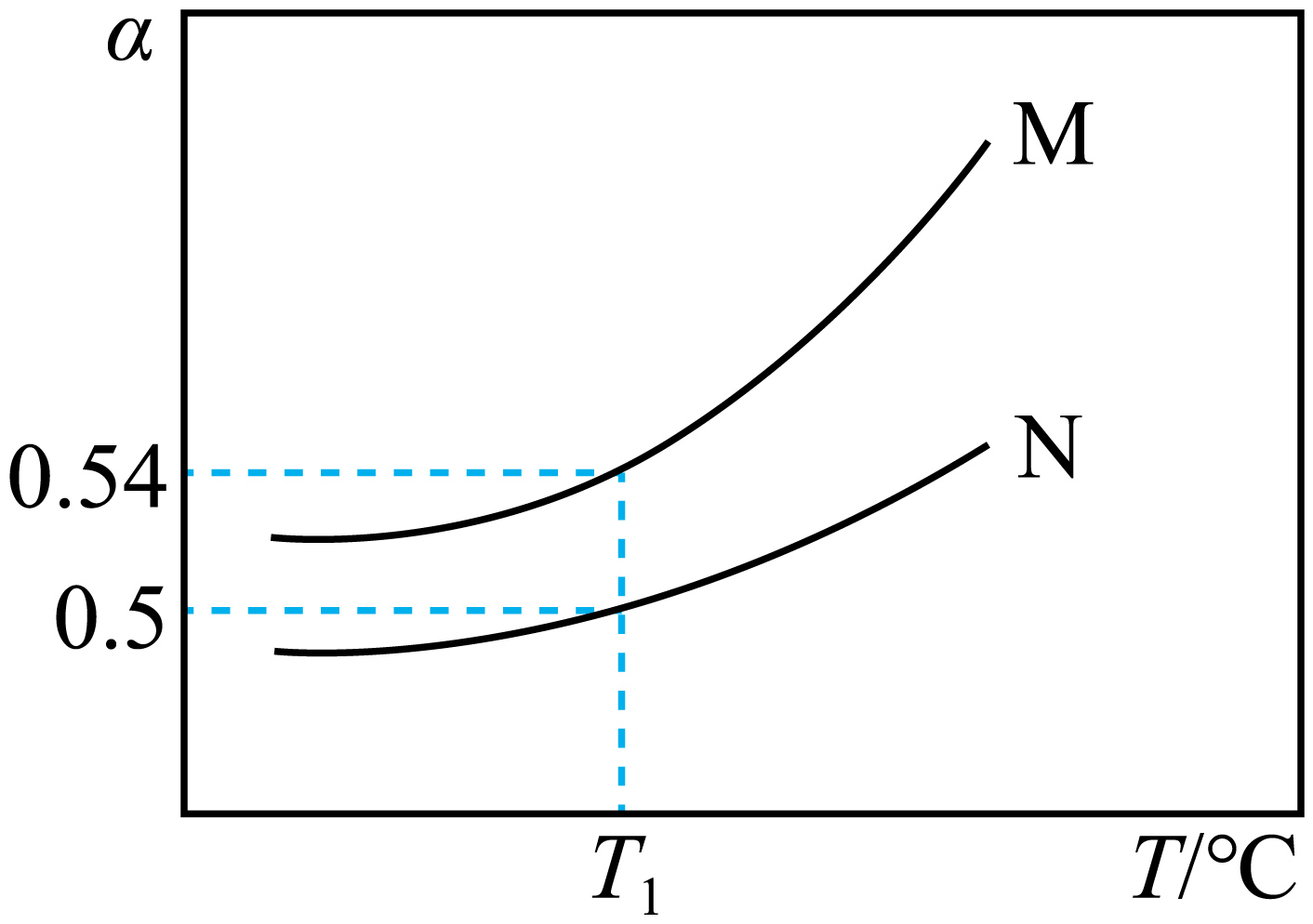
$\\rm M$ ; $\\rm 0.25$
"]]反应器总压为$1.0\,\text{MPa}$,投料比$x$越小,反应体系分压越小,该反应正向气体分子数增多,有利于反应正向进行,乙醇的平衡转化率$\alpha $增大,故$x=1$时的曲线为$\rm M$;${{T}_{1}}\text{ }{}^\circ \text{C}$时,投料比$x=\dfrac{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)}{n\left( {{\text{H}}_{2}}\text{O} \right)}=2$,乙醇的平衡转化率$\alpha $为$\rm 50\%$,设投料乙醇为$2x\,\text{mol}$,水蒸气为$x\,\text{mol}$,平衡时生成乙醛$x\,\text{mol}$,氢气$x\,\text{mol}$,余下乙醇$x\,\text{mol}$,容器内气体共为$4x\,\text{mol}$,则$p\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)=p\left( {{\text{H}}_{2}}\text{O} \right)=p\left( \text{C}{{\text{H}}_{3}}\text{CHO} \right)=\dfrac{x}{4x}\times 1.0\,\text{MPa}=0.25\,\text{MPa}$,反应$\text{a}$的平衡常数${{K}_{\text{p}}}=\dfrac{0.25\,\text{MPa}\times 0.25\,\text{MPa}}{0.25\,\text{MPa}}=0.25\,\text{MPa}$;
已知反应$\text{a}$的熵变$\Delta S=+115\,\,\text{J}/\left( \text{mol}\cdot \text{K} \right)$,假设焓变和熵变不随温度而变化,则反应$\text{a}$自发进行的最低温度为 $\rm K$。该反应耗能较大,$\rm 2023$年湖南大学的研究人员利用具有热催化和电催化活性的双功能催化剂,在低温$\rm (120\;\rm ^\circ\rm C)$和低电压$\rm (0.06\ V)$下,将热脱氢反应与电化学氢转移相结合,实现了乙醇制氢和乙醛的高效转化。其装置如图所示。则阳极总的电极方程式为: ;试从平衡原理解释该装置为什么能使反应$\rm a$在$\rm 120\;\rm ^\circ\rm C$进行 。
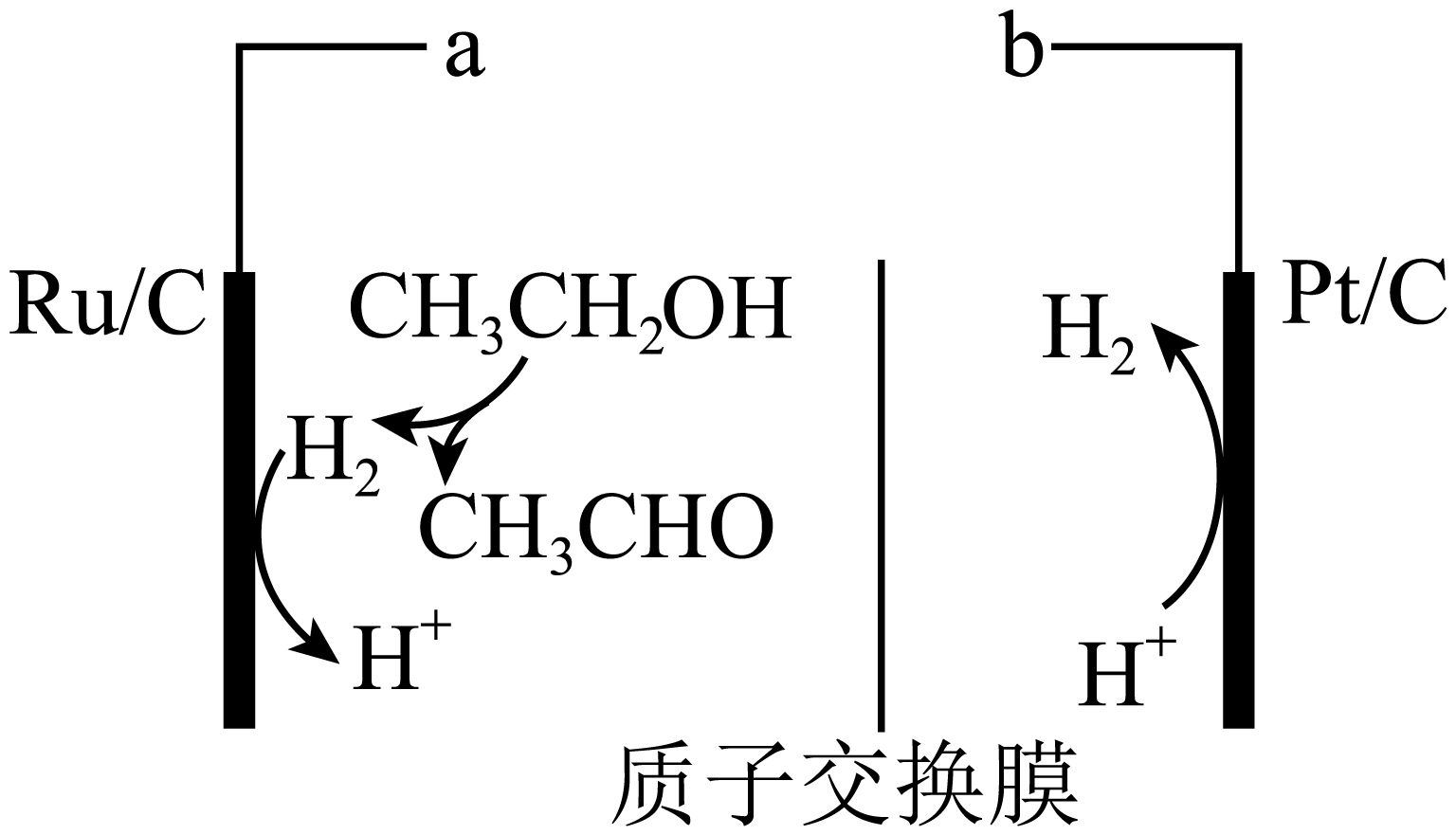
$\\rm 600$ ; ${{\\text{C}}_{2}}{{\\text{H}}_{5}}\\text{OH}\\left( \\text{g} \\right)-2{{\\text{e}}^{-}}=\\text{C}{{\\text{H}}_{3}}\\text{CHO}\\left( \\text{g} \\right)+2{{\\text{H}}^{+}}$ ; ${{\\text{H}}_{2}}$在阳极被氧化为${{\\text{H}}^{+}}$,减少了生成物浓度,使平衡正向移动
"]]根据$\Delta G=\Delta H-T\Delta S\lt 0$反应自发进行,$\Delta G=+\text{69}\,\text{kJ}/\text{mol}-T\times \text{0}.115\,\text{kJ}/\left( \text{mol}\cdot \text{K} \right)\lt \text{0}$,解得反应$\text{a}$自发进行的最低温度为$\rm 600$ $\rm K$;阳极乙醇发生氧化反应生成乙醛和氢气,氢气失电子生成氢离子,阳极总的电极方程式为${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)-2{{\text{e}}^{-}}=\text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+2{{\text{H}}^{+}}$;${{\text{H}}_{2}}$在阳极被氧化为${{\text{H}}^{+}}$,减少了生成物浓度,使平衡正向移动,能使反应$\rm a$在$\rm 120\;\rm ^\circ\rm C$进行。
高中 | 化学平衡常数题目答案及解析(完整版)
