高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{C}{{\text{O}}_{2}}$催化加氢制甲醇主要反应:
反应Ⅰ$\rm .\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})=\text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta {{\textit{H}}_{1}}=-49.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应Ⅱ$\rm .\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})=\text{CO}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta {{\textit{H}}_{2}}=+41.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
压强分别为${{p}_{1}}$、${{p}_{2}}$时,将$\dfrac{{{n}_{起始}}\left( \text{C}{{\text{O}}_{2}} \right)}{{{n}_{起始}}\left( {{\text{H}}_{2}} \right)}=1:3$的混合气体置于密闭容器中反应,不同温度下体系中$\text{C}{{\text{H}}_{3}}\text{OH}$或$\text{CO}$的平衡选择性如图所示。$\rm (\text{C}{{\text{H}}_{3}}\text{OH}\rm ($或$\text{CO}\rm )$的平衡选择性$=\dfrac{n\left( \text{C}{{\text{H}}_{3}}\text{OH}\right)或n(\text{CO})}{n\left( \text{C}{{\text{O}}_{2}} \right)参与反应}\rm )$
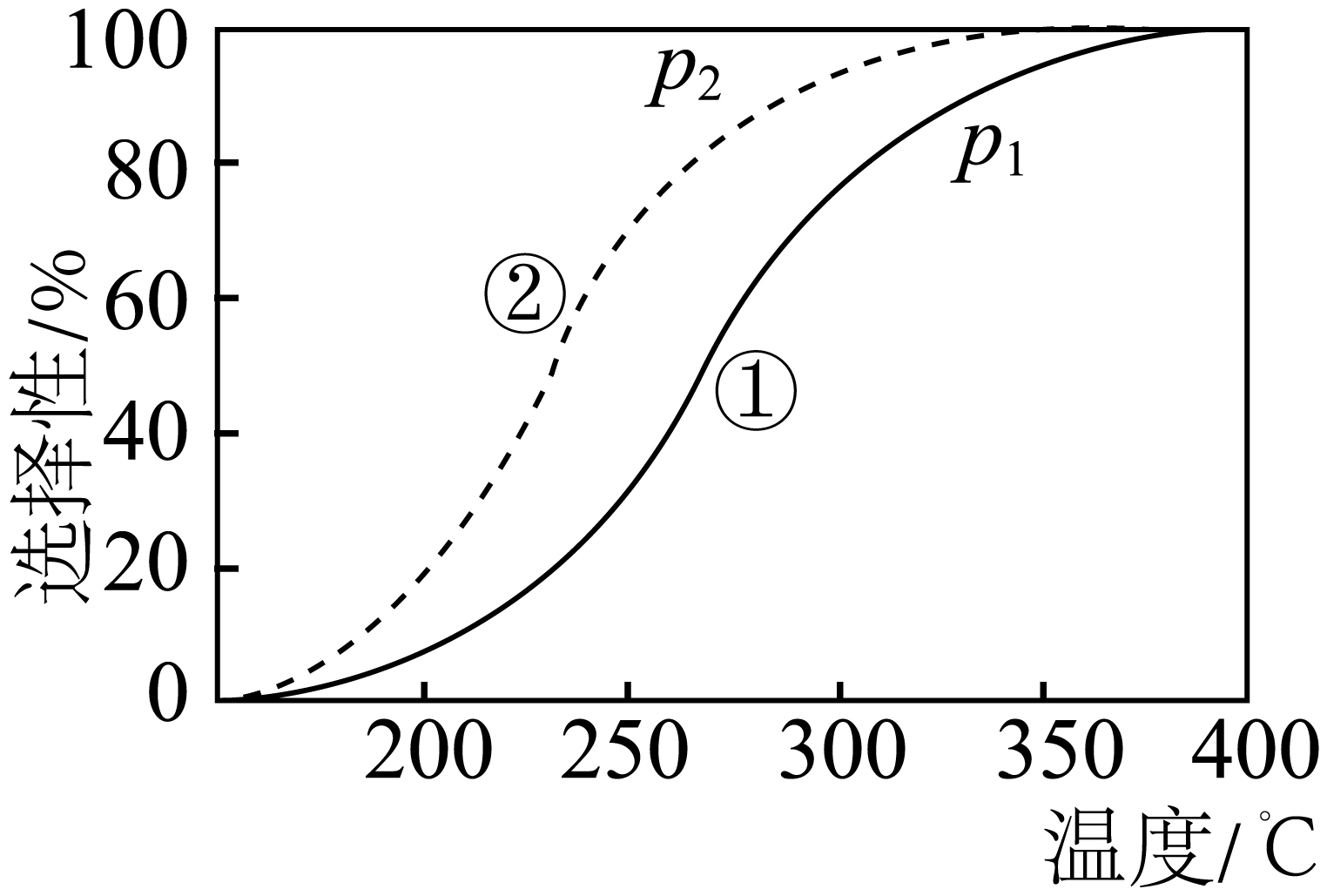
下列说法正确的是$(\qquad)$
曲线①、②表示的是$\\text{C}{{\\text{H}}_{3}}\\text{OH}$平衡选择性
","曲线①、②表示的压强:${{p}_{1}}\\lt {{p}_{2}}$
","随温度升高,$\\text{C}{{\\text{O}}_{2}}$的平衡转化率受压强影响减小
","相同温度下,压强分别为${{p}_{1}}$、${{p}_{2}}$时,反应Ⅰ的平衡常数$K\\left( _{p1}\\right)\\gt K\\left( _{p2}\\right)$
"]只看一条曲线,可知该物质的平衡选择性随温度升高而升高,反应Ⅰ为放热反应,升温平衡逆向移动,反应Ⅱ为吸热反应,升温平衡正向移动。故升温$\rm CO$的平衡选择性增大,符合图象。
$\rm A$.由上述分析可知,图中表示的是$\rm CO$的平衡选择性,$\rm A$错误;
$\rm B$.同一温度下,压强由$p_{1}$变为$p_{2}$,$\rm CO$的平衡选择性增大。根据反应可知,降压反应Ⅰ逆向移动,从而导致反应Ⅱ正向移动, $\rm CO$的平衡选择性增大,故$p_{1}\gt p_{2}$,$\rm B$错误;
$\rm C$.随温度升高,$\rm CO$的平衡选择性接近$\rm 100\%$,可知升温后主要发生反应Ⅱ,反应Ⅱ的平衡移动与压强无关,故随温度升高,$\text{C}{{\text{O}}_{2}}$的平衡转化率受压强影响减小,$\rm C$正确;
$\rm D$.平衡常数只与温度有关,温度相同平衡常数相同,$\rm D$错误;
故选:$\rm C$
高中 | 化学平衡常数题目答案及解析(完整版)
