高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
镀锌钢板广泛运用于汽车行业。当镀层质量不合格时,先利用强酸将镀件表面的镀锌层清洗,再检测其中含有的$\text{F}{{\text{e}}^{\text{3}+}}$、$\text{F}{{\text{e}}^{\text{2}+}}$、$\text{Z}{{\text{n}}^{\text{2}+}}$等离子的浓度。
测定原理:$\rm EDTA(\text{N}{{\text{a}}_{\text{2}}}{{\text{H}}_{\text{2}}}\text{Y}\cdot \text{2}{{\text{H}}_{\text{2}}}\text{O}\rm )$可与$\text{F}{{\text{e}}^{\text{3}+}}$、$\text{F}{{\text{e}}^{\text{2}+}}$、$\text{Z}{{\text{n}}^{\text{2}+}}$等多种金属离子形成络合物,如下表。其中${{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}$是乙二胺四乙酸根$\rm ($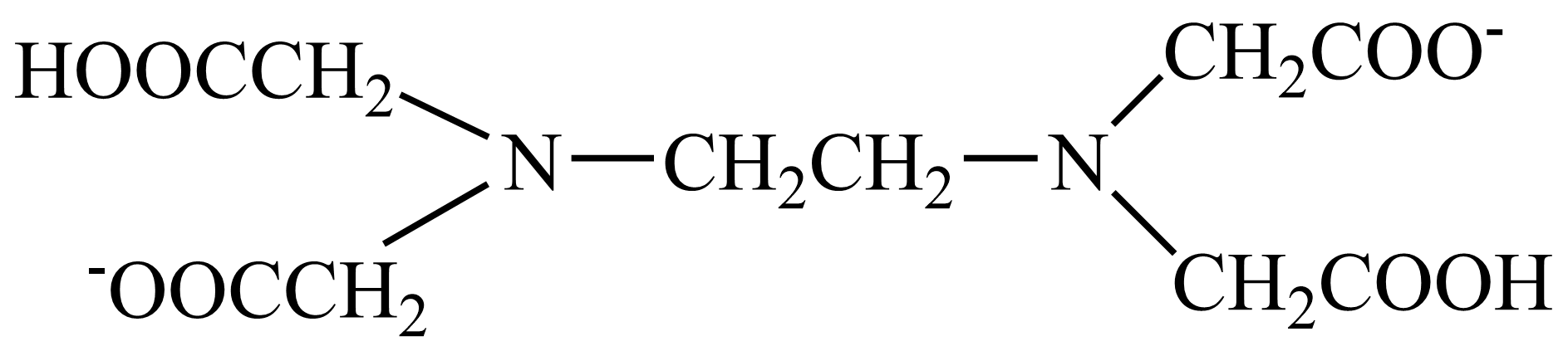 $\rm )$的简写。
$\rm )$的简写。
| 络合反应 | $\lg K (K$为平衡常数$\rm )$ |
| $\text{F}{{\text{e}}^{\text{2}+}}+{{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}\rightleftharpoons \text{Fe}{{\text{Y}}^{\text{2}-}}+\text{2}{{\text{H}}^{+}}$ | $\rm 14.3$ |
| $\text{Z}{{\text{n}}^{\text{2}+}}+{{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}\rightleftharpoons \text{Zn}{{\text{Y}}^{\text{2}-}}+\text{2}{{\text{H}}^{+}}$ | $\rm 16.5$ |
| $\text{F}{{\text{e}}^{\text{3}+}}+{{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}\rightleftharpoons \text{Fe}{{\text{Y}}^{-}}+\text{2}{{\text{H}}^{+}}$ | $\rm 25.1$ |
①$\rm EDTA$在水溶液中可看作“六元酸”的一种微粒可表示为 $\rm ($用$\rm H$、$\rm Y$表示$\rm )$。
②表中最稳定的金属络合物是 $\rm ($填化学式$\rm )$。
${{\\text{H}}_{\\text{6}}}{{\\text{Y}}^{\\text{2}+}}$;$\\text{Fe}{{\\text{Y}}^{-}}$
"]]①$\rm EDTA(\text{N}{{\text{a}}_{\text{2}}}{{\text{H}}_{\text{2}}}\text{Y}\cdot \text{2}{{\text{H}}_{\text{2}}}\text{O}\rm )$中${{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}$是乙二胺四乙酸根$\rm ($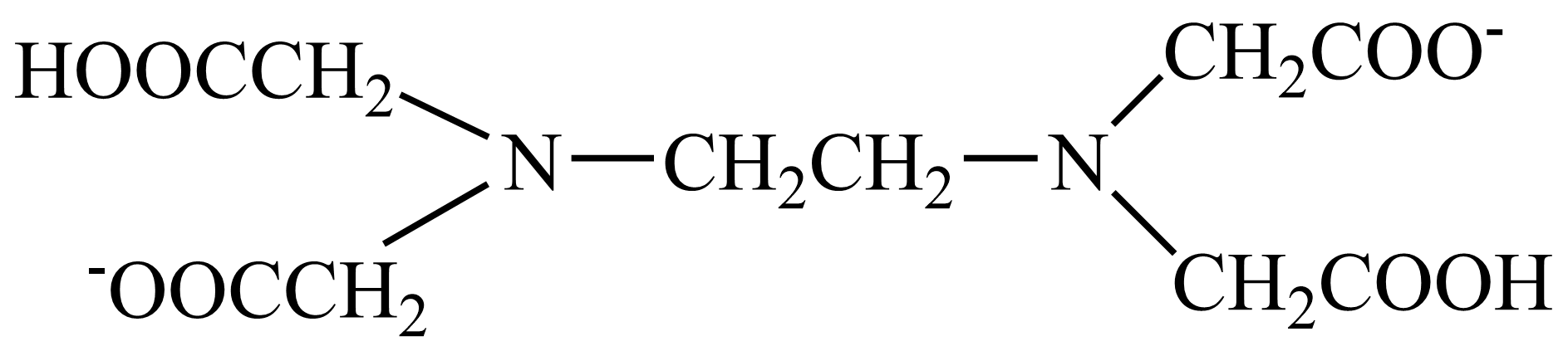 $\rm )$的简写,由此可推至$\rm Y$的价态是$\rm -4$价,则$\rm EDTA$在水溶液中可看作“六元酸”的一种微粒可表示为${{\text{H}}_{\text{6}}}{{\text{Y}}^{\text{2}+}}$;
$\rm )$的简写,由此可推至$\rm Y$的价态是$\rm -4$价,则$\rm EDTA$在水溶液中可看作“六元酸”的一种微粒可表示为${{\text{H}}_{\text{6}}}{{\text{Y}}^{\text{2}+}}$;
②$\text{F}{{\text{e}}^{\text{3}+}}+{{\text{H}}_{\text{2}}}{{\text{Y}}^{\text{2}-}}\rightleftharpoons \text{Fe}{{\text{Y}}^{-}}+\text{2}{{\text{H}}^{+}}$反应的平衡常数越大,表示正向进行的程度越大,即表示形成的配合物最稳定
测定过程:已知$\rm EDTA$标准溶液滴定$\text{F}{{\text{e}}^{\text{3}+}}$的相关信息如下表:
| 滴定对象 | $\text{F}{{\text{e}}^{\text{3}+}}$ |
| 滴定时溶液$\rm pH$范围 | $\rm 1.5$~$\rm 2.0$ |
| 指示剂 | 磺基水杨酸 |
| 滴定终点现象 | 紫红色$\rm →$亮黄色 |
可采用连续滴定法测定$\text{F}{{\text{e}}^{\text{3}+}}$、$\text{F}{{\text{e}}^{\text{2}+}}$、$\text{Z}{{\text{n}}^{\text{2}+}}$的浓度,具体步骤如下:
$\rm I$.先测定$\text{F}{{\text{e}}^{\text{3}+}}\rm (\text{F}{{\text{e}}^{\text{2}+}}$、$\text{Z}{{\text{n}}^{\text{2}+}}$不影响$\rm Fe^{3+}$的滴定$\rm )$:
请补充完整实验方案:
①按规定操作分别将$\rm 0.01000\;\text{mol}\cdot {{\text{L}}^{-\text{1}}}\;\rm EDTA$标准溶液和待测溶液[其中$c\left( \text{F}{{\text{e}}^{\text{3}+}} \right)$约为$\rm 0.01\; \text{mol}\cdot\text{L}^{-\text{1}}$]装入如图所示的滴定管中;
② 。$\rm ($可选用的实验试剂有:磺基水杨酸、氨水溶液、盐酸溶液$\rm )$
③实验测得$\text{F}{{\text{e}}^{\text{3}+}}$的浓度偏大,其原因可能是 。
$\rm II$.再测定$\text{F}{{\text{e}}^{\text{2}+}}$:在$\rm I$的锥形瓶中继续加入适量过硫酸铵$\left[{{\left(\text{N}{{\text{H}}_{\text{4}}}\right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}}\right]$$,轻微摇晃使$$\text{F}{{\text{e}}^{\text{2}+}}$$转化为$$\text{F}{{\text{e}}^{\text{3}+}}$$,继续用$$\rm EDTA$$标准溶液滴定到终点。写出$$\text{F}{{\text{e}}^{\text{2}+}}$$转化为$$\text{F}{{\text{e}}^{\text{3}+}}$的离子方程式 。
$\rm Ⅲ.$最后测定$\text{Z}{{\text{n}}^{\text{2}+}}$$:在$$\rm Ⅱ$的锥形瓶中继续加入一定量过量的$\rm EDTA$标准溶液,调节溶液$\rm pH$至$5.0\sim$ $6.0$,再用$\text{ZnC}{{\text{l}}_{\text{2}}}$标准溶液滴定到终点。$\text{F}{{\text{e}}^{\text{3}+}}$不影响$\text{Z}{{\text{n}}^{\text{2}+}}$滴定的原因是 。
取$\\rm 10-30\\;\\rm mL$待测液于锥形瓶中,用氨水及盐酸调节$\\rm pH$至$\\rm 1.5-2.0$,加入几滴磺酸水杨酸为指示剂,向锥形瓶中逐滴加入$\\rm 0.01000\\;\\rm mol/L\\;EDTA$标准溶液,当最后一滴标准液滴入时溶液恰好由紫红色变为亮黄色,且半分钟不褪色,记录标准溶液体积,重复实验$\\rm 2-3$次; $\\rm Fe^{2+}$被氧化为$\\rm Fe^{3+}$; $\\rm 2F{{\\text{e}}^{2+}}+{{\\text{S}}_{\\text{2}}}\\text{O}_{8}^{2-}=2F{{\\text{e}}^{3+}}+2\\text{SO}_{4}^{2-}$ ;在过量$\\rm EDTA$存在情况下,$\\rm Fe^{3+}$于$\\rm EDTA$形成稳定络合物,可以防止$\\rm Fe^{3+}$水解,从而对测定$\\rm Zn^{2+}$不产生干扰
"]]I.根据提示信息,该实验的方案是:取$10-30$ $\rm mL$待测液于锥形瓶中,用氨水及盐酸调节$\rm pH$至$1.5-2.0$,加入几滴磺酸水杨酸为指示剂,向锥形瓶中逐滴加入$\rm 0.01000\;mol/L\;EDTA$标准溶液,当最后一滴标准液滴入时溶液恰好由紫红色变为亮黄色,且半分钟不褪色,记录标准溶液体积,重复实验$2-3$次;由于$\rm Fe^{2+}$容易被氧化为$\rm Fe^{3+}$,所以会导致实验测得$\rm Fe^{3+}$的浓度偏大;
II. 硫酸铵$\left[ {{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}} \right]$,轻微摇晃使$\rm Fe^{2+}$转化为$\rm Fe^{3+}$,反应的离子方程式为:$\rm 2F{{\text{e}}^{2+}}+{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}=2F{{\text{e}}^{3+}}+2\text{SO}_{4}^{2-}$;
III. 最后测定$\text{Z}{{\text{n}}^{\text{2}+}}$:在$\rm Ⅱ$的锥形瓶中继续加入一定量过量的$\rm EDTA$标准溶液,在过量$\rm EDTA$存在情况下,$\rm Fe^{3+}$于$\rm EDTA$形成稳定络合物,可以防止$\rm Fe^{3+}$水解,从而对测定$\rm Zn^{2+}$不产生干扰。
高中 | 化学平衡常数题目答案及解析(完整版)
