高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
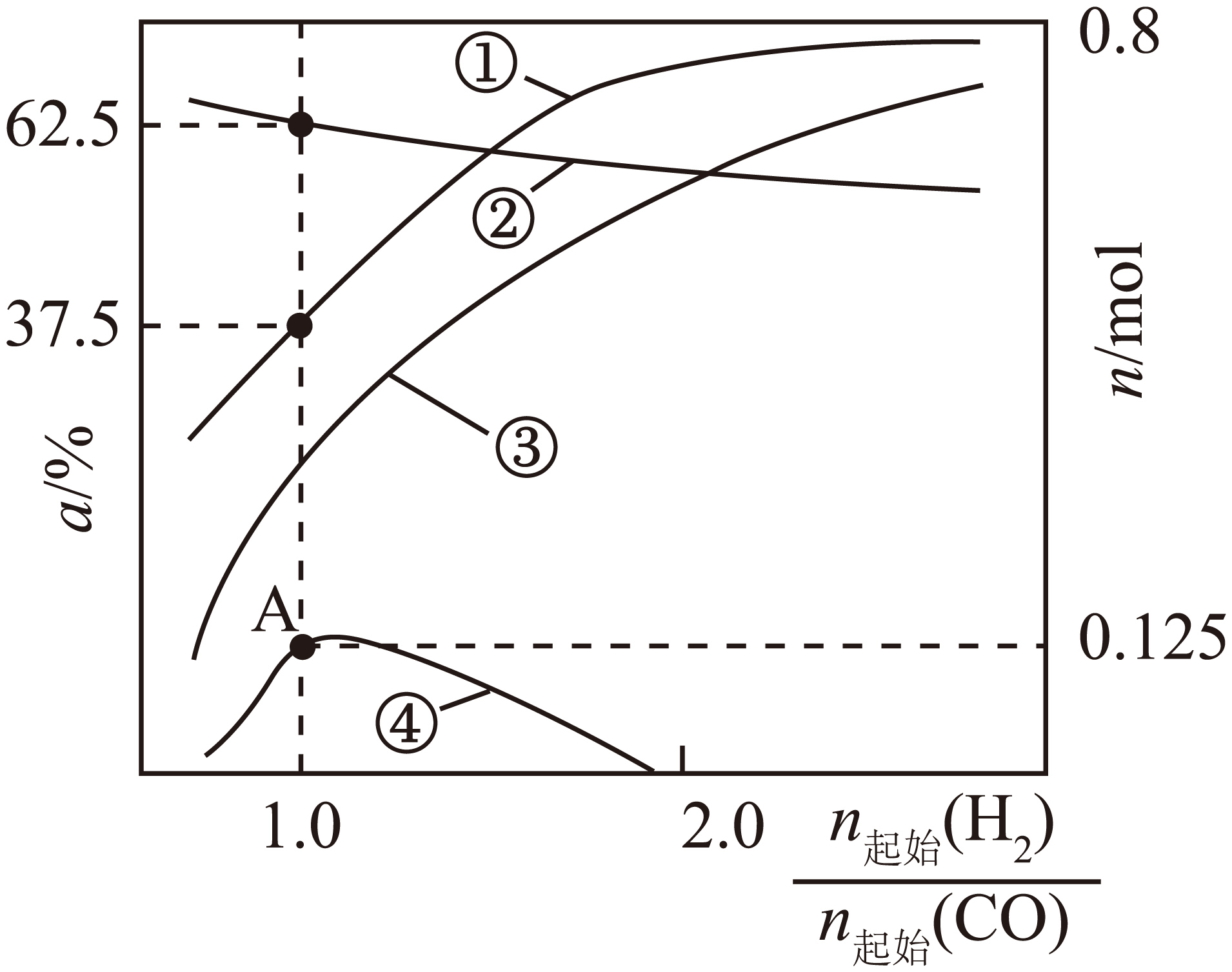
温度为${{T}_{1}}$时,将一定量的${{\text{H}}_{2}}$和$\rm 1\;\rm mol$ $\rm CO$混合气充入固定容积的容器,发生下列反应:
Ⅰ$\rm .\text{CO}\left( \text{g}\right)+3\text{H}_{2}\left( \text{g}\right)=\text{C}\text{H}_{4}\left( \text{g}\right)+\text{H}_{2}\text{O}\left( \text{g}\right)\qquad\Delta\textit{H}_{\text{1}}$
Ⅱ$.\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)={{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta {{H}_{2}}=-41.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
平衡时${{\text{H}}_{2}}$和$\rm CO$的转化率($\alpha $)及$\text{C}{{\text{H}}_{4}}$和$\text{C}{{\text{O}}_{2}}$的物质的量$(n)$随起始投料比$\dfrac{{{n}_{起始}}\left( {{\text{H}}_{2}} \right)}{{{n}_{起始}}\left( \text{CO} \right)}$变化如图所示。$\rm [$选择性以$\text{C}{{\text{H}}_{4}}$为例,表示为$\dfrac{n\left( \text{C}{{\text{H}}_{4}} \right)}{n\left( \text{C}{{\text{O}}_{2}} \right)+n\left( \text{C}{{\text{H}}_{4}} \right)}\times 100\%\rm ]$。下列说法正确的是$(\qquad)$
$\\Delta {{H}_{1}}\\gt 0$
","图中曲线①表示平衡时${{\\text{H}}_{2}}$的转化率随$\\dfrac{{{n}_{起始}}\\left( {{\\text{H}}_{2}} \\right)}{{{n}_{起始}}\\left( \\text{CO} \\right)}$的变化
","$\\dfrac{{{n}_{起始}}\\left( {{\\text{H}}_{2}} \\right)}{{{n}_{起始}}\\left( \\text{CO} \\right)}=1$,温度为${{T}_{2}}$时,反应Ⅱ的$K=1$,则${{T}_{2}}\\gt {{T}_{1}}$
","$\\rm A$点对应物质的选择性为$\\rm 33.3\\%$
"]反应Ⅰ、Ⅱ的总反应为:$\rm 2CO(g)+2H_{2}(g)=CH_{4}(g)+CO_{2}(g)$,起始$\dfrac{n\left( \text{H}_{2}\right)}{n\left(\rm CO\right)}$越大,反应正向进行程度越大,$\rm CO$转化率越大,直到接近$\rm 100\%$,而$\rm H_{2}$的转化率减小,则曲线①表示$\rm CO$的转化率,曲线②表示$\rm H_{2}$的转化率;同时随着起始$\dfrac{n\left( \text{H}_{2}\right)}{n\left(\rm CO\right)}$的增大,$\rm CH_{4}$的产率也逐渐增大,因生成的$\rm CO_{2}$与$\rm H_{2}$会发生反应,导致$\rm CO_{2}$物质的量先增大后减小,则曲线③表示$\rm CH_{4}$的物质的量,曲线④表示$\rm CO_{2}$的物质的量,据此解答。
$\rm A$.反应Ⅰ的$\Delta\textit{S}_0$,则$-\textit{T}\Delta\textit{S}_{0}\gt0$,只有$\Delta\textit{H}_{1}\lt 0$,反应才能自发进行,$\rm A$错误;
$\rm B$.由分析可知,曲线②表示平衡时${{\text{H}}_{2}}$的转化率随$\dfrac{{{n}_{起始}}\left( {{\text{H}}_{2}} \right)}{{{n}_{起始}}\left( \text{CO} \right)}$的变化,$\rm B$错误;
$\rm C$.温度为$\rm \textit{T}_{1}$时,$\alpha\left( {{\text{H}}_{2}} \right)=62.5\%$,$\alpha\left(\rm CO\right)=37.5\%$,平衡时:$\textit{n}\left(\rm C{{O}_{2}} \right)=0.125\;\rm mol$、$\textit{n}\left(\rm CO \right)=1-1\times 37.5\%=0.625\;\rm mol$、$\textit{n}\left( {{\text{H}}_{2}} \right)=1-1\times 62.5\%=0.375\;\rm mol$,根据氧元素守恒可知,$\textit{n}\left( {{\text{H}}_{2}}\text{O} \right)=1-\textit{n}\left(\rm CO \right)-2\textit{n}\left(\rm C{{O}_{2}} \right)=1-0.625-0.125\times 2=0.125\;\rm mol$,反应Ⅱ平衡常数$\textit{K}=\dfrac{\dfrac{0.125}{\textit{V}}\times\dfrac{0.375}{\textit{V}}}{\dfrac{0.625}{\textit{V}}\times\dfrac{0.125}{\textit{V}}}=0.6\lt 1$,该反应为放热反应,温度越高,平衡常数越小,则$\textit{T}_{2}\lt \textit{T}_{1}$,$\rm C$错误;
$\rm D$.根据碳守恒:$\textit{n}\left(\rm C{{H}_{4}} \right)=1-\textit{n}\left(\rm C{{O}_{2}} \right)-\textit{n}\left(\rm CO \right)=0.25\;\rm mol$,则$\text{C}{{\text{O}}_{2}}$的选择性:$\dfrac{0.125\;\rm mol}{0.125\;\rm mol+0.25\;\rm mol}\times 100\%=33.3\%$,$\rm D$正确;
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
