高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
拥有中国自主知识产权的全球首套煤制乙醇工业化项目投产成功。某煤制乙醇过程表示如下:

过程$\rm a$包括以下$\rm 3$个主要反应:
Ⅰ.$\text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)={{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)\qquad\Delta{{\textit{H}}_{\text{1}}}$
Ⅱ.$\text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}}\left( \text{g} \right)+{{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)\text{=C}{{\text{H}}_{3}}\text{COO}{{\text{C}}_{2}}{{\text{H}}_{5}}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)\qquad\Delta{{\textit{H}}_{\text{2}}}$
Ⅲ.$\text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{CHO}\left( \text{g} \right)+\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)\qquad\Delta{{\textit{H}}_{3}}$ 相同时间内,测得乙酸甲酯转化率随温度的变化如图$\rm 1$所示,乙醇和乙酸乙酯的选择性$\rm [$乙醇选择性$=\dfrac{n\left( \mathrm{最终转化为乙醇的}\text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}} \right)}{n\left(转化的 \text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}} \right)}\rm ]$随温度的变化如图$\rm 2$所示。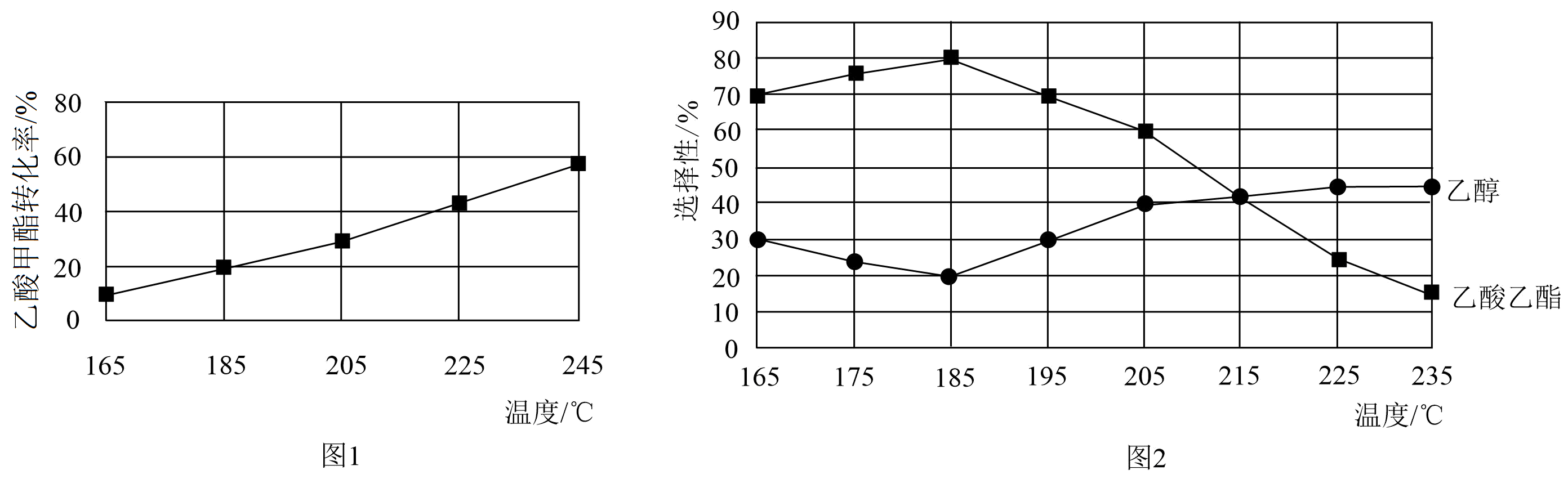 下列说法不正确的是$(\qquad)$
下列说法不正确的是$(\qquad)$
$\\rm 205\\;\\rm ^\\circ\\rm C$后反应Ⅲ开始发生反应
","$\\rm 225\\sim 235\\;\\rm ^\\circ\\rm C$,反应$\\rm I$处于平衡状态
","温度可影响催化剂的选择性,从而影响目标产物乙醇的选择性
","$\\rm 205\\;\\rm ^\\circ\\rm C$时,$\\rm CH_{3}COOCH_{3}$起始物质的量为$\\rm 5\\;\\rm mol$,转化率为$\\rm 30\\%$,则最终生成乙醇$\\rm 0.6\\;\\rm mol$
"]$\rm A$.由图$\rm 2$可知,温度$T$$\rm \leqslant \rm 205\;\rm ^\circ\rm C$时,乙醇和乙酸乙酯的选择性之和为$\rm 100\%$,而温度在大于$\rm 205\;\rm ^\circ\rm C$时,乙醇和乙酸乙酯的选择性之和小于$\rm 100\%$,说明温度$T\leqslant $$\rm 205\;\rm ^\circ\rm C$时,反应Ⅲ未开始,温度在大于$\rm 205\;\rm ^\circ\rm C$时,反应Ⅲ开始生成副产物$\rm CH_{3}CHO$,$\rm A$正确;
$\rm B$.由①知反应Ⅰ正向放热,升高温度,平衡逆向移动,$\rm CH_{3}COOCH_{3}$的平衡转化率减小,由图$\rm 1$可知,$\rm 225\;\rm ^\circ\rm C\sim 235\;\rm ^\circ\rm C$,$\rm CH_{3}COOCH_{3}$的转化率增大,说明反应Ⅰ未达到平衡状态,$\rm B$错误;
$\rm C$.由图$\rm 2$可知,温度可影响催化剂的选择性,从而影响目标产物的选择性,$\rm C$正确;
$\rm D$.在$\rm 205\;\rm ^\circ\rm C$时,$\rm CH_{3}COOCH_{3}$起始物质的量为$\rm 5\;\rm mol$,转化率为$\rm 30\%$,则$n\rm($转化的$\rm CH_{3}COOCH_{3})=5\;\rm mol\times 30\%=1.5\;\rm mol$,由图$\rm 2$可知,乙醇的选择性为$\rm 40\%$,则$n\rm($最终转化为为乙醇的$\rm CH_{3}COOCH_{3})=\textit{n}($转化的$\rm CH_{3}COOCH_{3})\times 40\%=1.5\;\rm mol\times 40\%=0.6\;\rm mol$,根据反应Ⅰ可知,生成乙醇的物质的量为$\rm 0.6\;\rm mol$,$\rm D$正确;
故选:$\rm B$
高中 | 化学平衡图像分析题目答案及解析(完整版)
