高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
工业上常用$\mathrm{CeO}_{2}$催化除去重整气(主要成分为${{\text{H}}_{2}}$、$\text{C}{{\text{O}}_{2}}$、$\text{CO}$、${{\text{N}}_{2}}$、${{\text{H}}_{2}}\text{O}$和少量${{\text{O}}_{2}}$等)中含有的少量$\text{CO}$。主要反应为$2\text{CO}+{{\text{O}}_{2}}=2\text{C}{{\text{O}}_{2}}$;$\text{CO}+3{{\text{H}}_{2}}=\text{C}{{\text{H}}_{4}}+{{\text{H}}_{2}}\text{O}$
用大孔径的催化剂载体可以提高催化氧化$\text{CO}$效果。
①制备泡沫铜载体。三羟甲基氨基甲烷(${{\text{C}}_{4}}{{\text{H}}_{11}}\text{N}{{\text{O}}_{3}}$)和硝酸铜混合均匀,在氩气的保护下点燃,冷却清洗后得到泡沫铜。三羟甲基氨基甲烷作用为 。
②$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$做载体。$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$导热性差,会导致反应管温度过高$\text{CO}$去除率明显降低,除因为催化剂失活外,还有 (用化学方程式表示)。
做燃料,产生大量气体造孔,提供还原性气体还原氧化铜为铜单质; $\\text{C}\\text{O}_{2}+\\text{H}_{2}\\begin{array}{c} {\\underline{\\underline{催化剂}}}\\\\{\\triangle} \\end{array}\\text{CO}+\\text{H}_{2}\\text{O}$
"]]①三羟甲基氨基甲烷(${{\text{C}}_{4}}{{\text{H}}_{11}}\text{N}{{\text{O}}_{3}}$)和硝酸铜混合均匀,在氩气的保护下点燃,冷却清洗后得到泡沫铜。三羟甲基氨基甲烷作用为:做燃料,产生大量气体造孔,提供还原性气体还原氧化铜为铜单质;
②$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$导热性差,会导致反应管温度过高,CO2和H2在高温下反应生成CO和H2O,化学方程式为:
$\text{C}\text{O}_{2}+\text{H}_{2}\begin{array}{c} {\underline{\underline{催化剂}}}\\{\triangle} \end{array}\text{CO}+\text{H}_{2}\text{O}$
$\mathrm{CeO}_{2}$(Ce是活泼金属)中添加$\text{CuO}$能提高反应催化效果。将$n\left( \text{CO} \right):n\left( {{\text{O}}_{2}} \right):n\left( {{\text{H}}_{2}} \right):n\left( \text{C}{{\text{O}}_{2}} \right)$$:n\left( {{\text{H}}_{2}}\text{O} \right)=1:1:50:15:10$的混合气体(其余为氮气)以一定流速通过装有$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$催化剂的反应管,实验表明催化剂中氧空位的数量影响反应速率,可能机理如图-1所示。
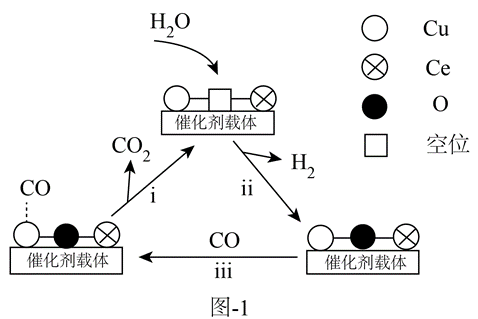
①$\mathrm{CeO}_{2}$中加入少量$\text{CuO}$能提高$\text{CO}$的去除率,其原因是 。
②催化剂$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$中铜原子上会形成少量碱性基团(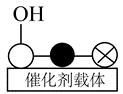 ),其存在会降低$\text{CO}$去除率的原因是 。
),其存在会降低$\text{CO}$去除率的原因是 。
③步骤ⅱ氧气也会参与反应。若参加反应的${{\text{H}}_{2}}\text{O}$和${{\text{O}}_{2}}$物质的量相等,则每转化$1\;\text{mol}$ $\text{CO}$产生${{\text{H}}_{2}}$的物质的量为 。
增强了$\\text{CO}$在$\\text{CuO}$上的吸附量,$\\text{C}{{\\text{u}}^{2+}}$代替$\\text{C}{{\\text{e}}^{4+}}$增加了催化剂中氧空位的数量;$\\text{C}{{\\text{O}}_{2}}$与$\\text{CO}$产生竞争吸附(使$\\text{CO}$不易吸附),产生碳酸盐覆盖催化剂表面,阻碍反应发生;$\\dfrac{1}{3}\\ \\text{mol}$
"]]①$\mathrm{CeO}_{2}$中加入少量$\text{CuO}$能提高$\text{CO}$的去除率,其原因是增强了$\text{CO}$在$\text{CuO}$上的吸附量;$\text{C}{{\text{u}}^{2+}}$代替$\text{C}{{\text{e}}^{4+}}$增加了催化剂中氧空位的数量;
②催化剂$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$中铜原子上会形成少量碱性基团(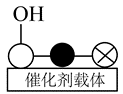 ),其存在会降低$\text{CO}$去除率的原因是:$\text{C}{{\text{O}}_{2}}$与$\text{CO}$产生竞争吸附(使$\text{CO}$不易吸附);产生碳酸盐覆盖催化剂表面,阻碍反应发生;
),其存在会降低$\text{CO}$去除率的原因是:$\text{C}{{\text{O}}_{2}}$与$\text{CO}$产生竞争吸附(使$\text{CO}$不易吸附);产生碳酸盐覆盖催化剂表面,阻碍反应发生;
③步骤ⅱ氧气也会参与反应,若参加反应的${{\text{H}}_{2}}\text{O}$和${{\text{O}}_{2}}$物质的量相等,根据得失电子守恒和原子守恒配平化学方程式为:$\rm {{\text{H}}_{2}}\text{O}+{{\text{O}}_{2}}+3CO={{\text{H}}_{2}}+3CO_2$,则每转化$1\ \text{mol}$ $\text{CO}$产生${{\text{H}}_{2}}$的物质的量为$\dfrac{\text{1}}{\text{3}}\;\rm mol$。
$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$、$a\text{Cu}\cdot b\text{Ce}{{\text{O}}_{2}}$均能催化$\text{CO}$反应。重整气通过装有$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$催化剂的反应管,$\text{CO}$的转化率和生成$\text{C}{{\text{O}}_{2}}$选择性随温度变化的曲线如图-2所示。
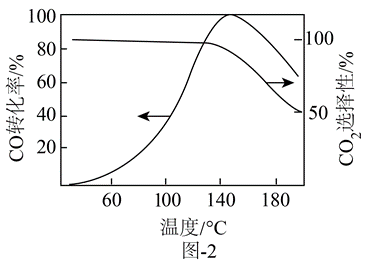
①产物$\text{C}{{\text{O}}_{2}}$选择性下降的原因可能是 。
②$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$相对于$a\text{Cu}\cdot b\text{Ce}{{\text{O}}_{2}}$催化剂,其优点是 。
氢气还原氧化铜为铜,$\\text{Ce}{{\\text{O}}_{2}}-\\text{Cu}$催化剂有利于甲烷的生成;产物二氧化碳选择性高,不消耗${{\\text{H}}_{2}}$
"]]①主要反应为$2\text{CO}+{{\text{O}}_{2}}=2\text{C}{{\text{O}}_{2}}$;$\text{CO}+3{{\text{H}}_{2}}=\text{C}{{\text{H}}_{4}}+{{\text{H}}_{2}}\text{O}$,产物$\text{C}{{\text{O}}_{2}}$选择性下降的原因可能是:氢气还原氧化铜为铜,$\text{Ce}{{\text{O}}_{2}}-\text{Cu}$催化剂有利于甲烷的生成;
②由图可知,$a\text{CuO}\cdot b\text{Ce}{{\text{O}}_{2}}$相对于$a\text{Cu}\cdot b\text{Ce}{{\text{O}}_{2}}$催化剂,其优点是产物二氧化碳选择性高,不消耗${{\text{H}}_{2}}$。
高中 | 化学平衡图像分析题目答案及解析(完整版)
