高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm CO_{2}$加氢制甲醚的反应原理:$\rm 2CO_{2}(g)+6H_{2}(g)\rightleftharpoons \rm CH_{3}OCH_{3}(g)+3H_{2}O(g)$ $\qquad\Delta H$
其分步反应及副反应如下:
$\rm I$.$\rm CO_{2}(g)+3H_{2}(g)\rightleftharpoons \rm CH_{3}OH(g)+H_{2}O(g)$ $\qquad\Delta {{H }_{1}}=-49.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
Ⅱ.$\rm 2CH_{3}OH(g)\rightleftharpoons \rm CH_{3}OCH_{3}(g)+H_{2}O(g)$ $\qquad\Delta {{H}_{2}}=-23.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\quad\Delta {{\textit{S}}_{2}}\lt 0$
Ⅲ.$\rm CO_{2}(g)+H_{2}(g)\rightleftharpoons \rm CO(g)+H_{2}O(g)$ $\qquad\Delta {{H }_{3}}=+41.1\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
回答下列问题:
$\Delta H =$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,上述反应的$\Delta G$随温度的变化如图,其中表示反应Ⅲ的$\Delta G$随温度的变化曲线是 $\rm ($填$\rm a$、$\rm b$或$\rm c)$。
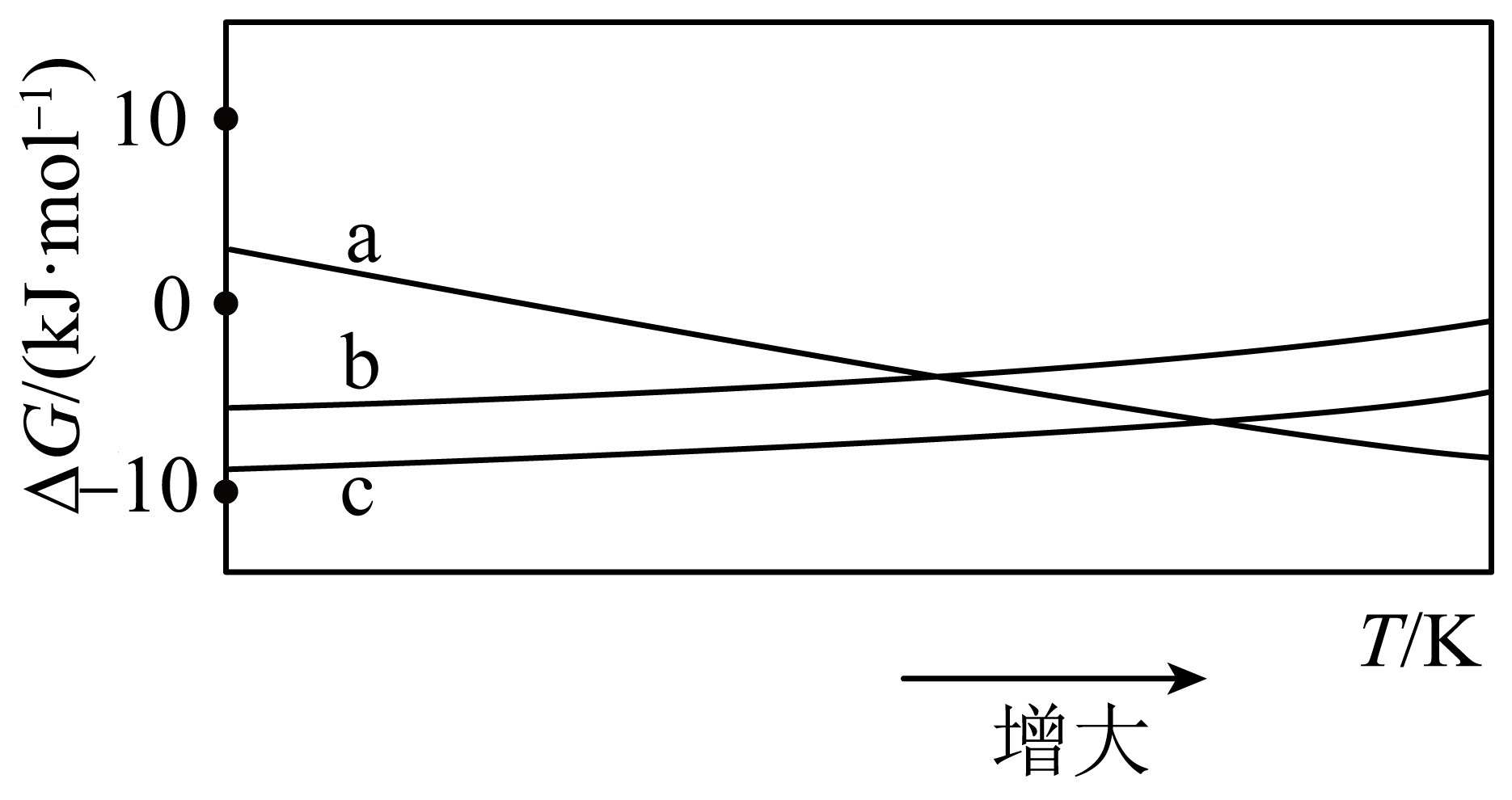
$\\rm -122.2$ ; $\\rm a$
"]]由盖斯定律可知反应$\rm 2CO_{2}(g)+6H_{2}(g)\rightleftharpoons \rm CH_{3}OCH_{3}(g)+3H_{2}O(g)$可由$\rm 2\times $Ⅰ$\rm +$Ⅱ得到,则$\Delta H \rm =2\Delta {\textit{H}_{1}}+\Delta {\textit{H}_{2}}=-49.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times 2+(-23.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}})\rm =-122.2\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
由反应可知反应Ⅰ中,$\Delta \textit{S}\lt 0$,$\Delta {\textit{H}_{1}}\lt 0$;反应Ⅱ中$\Delta {{H}_{2}}\lt 0$、$\Delta {{\textit{S}}_{2}}\lt 0$,则反应Ⅰ和反应Ⅱ的$ \Delta G$随温度的变化曲线变化趋势相同,结合图像可知,$\rm b$、$\rm c$代表反应Ⅰ、反应Ⅱ,则$\rm a$代表反应Ⅲ的$ \Delta G$随温度的变化曲线;
在$\rm 4.0\ MPa$条件下,将$\rm 1\;\rm mol$ $\rm CO_{2}$、$\rm 3\;\rm mol$ $\rm H_{2}$通入反应器发生反应$\rm I$、Ⅱ、Ⅲ,测得$\rm CO_{2}$平衡转化率、$\rm CH_{3}OH$产率与温度的关系如图所示。
已知:$\rm X$产率$\rm =\dfrac{\textit{n}(X)}{{{\textit{n}}_{理论}}\text{(X)}}\times 100\%$,$n_{理论}\rm(X)$表示$\rm CO_{2}$完全转化为$\rm X$时对应生成$\rm X$的物质的量,$\rm X$表示$\rm CH_{3}OH$、$\rm CO$、$\rm CH_{3}OCH_{3}$。
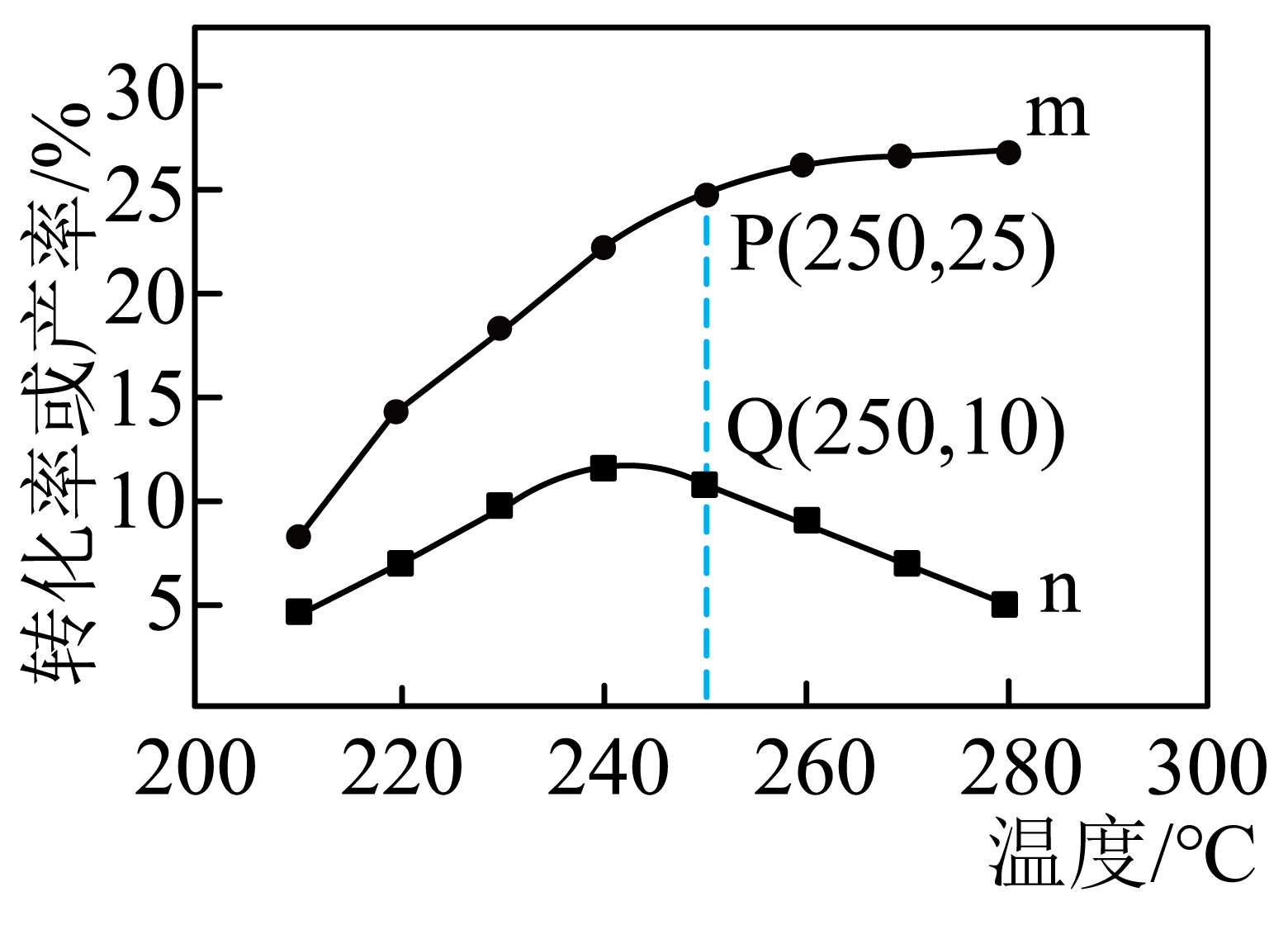
①表示$\rm CH_{3}OH$产率的曲线是 $\rm ($填$\rm m$或$\rm n)$。
②$\rm 250\;\rm ^\circ\rm C$,测得平衡体系中$\rm H_{2}O$的物质的量为$\rm 0.3\;\rm mol$,则甲醚的产率为 ,该温度下反应Ⅱ的$ K_\rm{P}=$ 。
③$\rm 240\;\rm ^\circ\rm C\sim 280\;\rm ^\circ\rm C$温度范围内,甲醚的选择性随温度升高而 $\rm ($填“增大”、“减小”或“不变”$\rm )$。已知:甲醚的选择性$\rm =\dfrac{生成甲醚所消耗\text{C}{{\text{O}}_{\text{2}}}的物质的量}{所消耗\text{C}{{\text{O}}_{\text{2}}}的总物质的量}\times 100\%$
$\rm 210\;\rm ^\circ\rm C-240\;\rm ^\circ\rm C$温度范围内,随温度升高$\rm n$曲线对应的量逐渐增大的原因是 。
$\\rm n$ ; $\\rm 10\\%$ ; $\\rm 1.5$ ; 减小 ; $\\rm 210\\;\\rm ^\\circ\\rm C\\sim \\rm 240\\;\\rm ^\\circ\\rm C$温度范围内,升高温度,反应Ⅰ逆向移动使$\\rm CH_{3}OH$减少,反应Ⅱ逆向移动使$\\rm CH_{3}OH$增多,$\\rm 240\\;\\rm ^\\circ\\rm C$前升温对反应Ⅱ影响更大
"]]①由反应可知$\rm CO_{2}$最终可转化为$\rm CH_{3}OH$、$\rm CO$、$\rm CH_{3}OCH_{3}$三种物质,其转化率始终高于$\rm CH_{3}OH$的产率;则$\rm m$代表$\rm CO_{2}$平衡转化率、$\rm n$代表$\rm CH_{3}OH$产率;
②$\rm 250\;\rm ^\circ\rm C$,$\rm CO_{2}$平衡转化率为$\rm 25\%$,$\rm CH_{3}OH$产率为$\rm 10\%$,则此时$n\rm(CO_{2})=0.75\;\rm mol$,$ n\rm(CH_{3}OH)=0.1\;\rm mol$,设生成的$\rm CH_{3}OCH_{3}$的物质的量为$ x\rm\ mol$,$\rm CO$为$ y\rm\ mol$,则根据$\rm C$原子守恒得:$ 2x+y=0.25-0.1=0.15$;根据$\rm O$原子守恒得:$ 2n\rm(CO_{2})+\textit{n}(CO)+\textit{n}(CH_{3}OH)+\textit{n}(CH_{3}OCH_{3})+\textit{n}(H_{2}O)=2$,即$ 0.75\times 2+y+0.1+x+0.3=2$,联立解得$ x=y=0.05$,理论上生成甲醚$\rm 0.5\;\rm mol$;则甲醚的产率为$\dfrac{0.05}{0.5}\times 100\%=10\%$;根据$\rm H$原子守恒得:$ 2n\rm(H_{2})+$ $ 4n\rm(CH_{3}OH)+2\textit{n}(H_{2}O)+6\textit{n}(CH_{3}OCH_{3})=6$,即$ 2n\rm(H_{2})+4\times 0.1+2\times 0.3+6\times 0.05=6$,解得:$ n\rm(H_{2})=2.35\;\rm mol$;
该温度下反应Ⅱ的$ K_\rm{P}=\dfrac{\textit{p}{{\text{(H}}_{\text{2}}}\text{O)}\cdot \textit{p}{(C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}\text{)}}{{{\textit{p}}^{\text{2}}}\text{(C}{{\text{H}}_{\text{3}}}\text{OH)}}\rm =\dfrac{\dfrac{\textit{n}{{\text{(H}}_{\text{2}}}\text{O)}}{\textit{n}\text{(总)}}{{\textit{p}}_{\text{(总}\text{)}}}\cdot \dfrac{\textit{n}{(C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}\text{)}}{\textit{n}\text{(总)}}{{\textit{p}}_{\text{(总}\text{)}}}}{\dfrac{{{\textit{n}}^{\text{2}}}\text{(C}{{\text{H}}_{\text{3}}}\text{OH)}}{{{\textit{n}}^{2}}\text{(总}\text{)}}{{\textit{p}}^{2}}_{\text{(总}\text{)}}}\rm =\dfrac{\textit{n}{{\text{(H}}_{\text{2}}}\text{O)}\cdot \textit{n}{(C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}\text{)}}{{{\textit{n}}^{\text{2}}}\text{(C}{{\text{H}}_{\text{3}}}\text{OH)}}=\dfrac{0.3\times 0.05}{{{0.1}^{2}}}=1.5$;
③随温度升高,反应Ⅱ逆向移动,则甲醚的选择性减小;$\rm 210\;\rm ^\circ\rm C\sim \rm 240\;\rm ^\circ\rm C$温度范围内,升高温度,反应Ⅰ逆向移动使$\rm CH_{3}OH$减少,反应Ⅱ逆向移动使$\rm CH_{3}OH$增多,$\rm 240\;\rm ^\circ\rm C$前升温对反应Ⅱ影响更大,因此甲醇的产率逐渐增大。
高中 | 化学平衡常数题目答案及解析(完整版)
