高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
以赤泥熔炼渣$\rm ($主要成分为$\rm Fe_{2}O_{3}$、$\rm SiO_{2}$、$\rm CaO$,少量$\rm Sc_{2}O_{3})$为原料分离稀土元素钪$\rm (Sc)$的一种工艺流程如下:
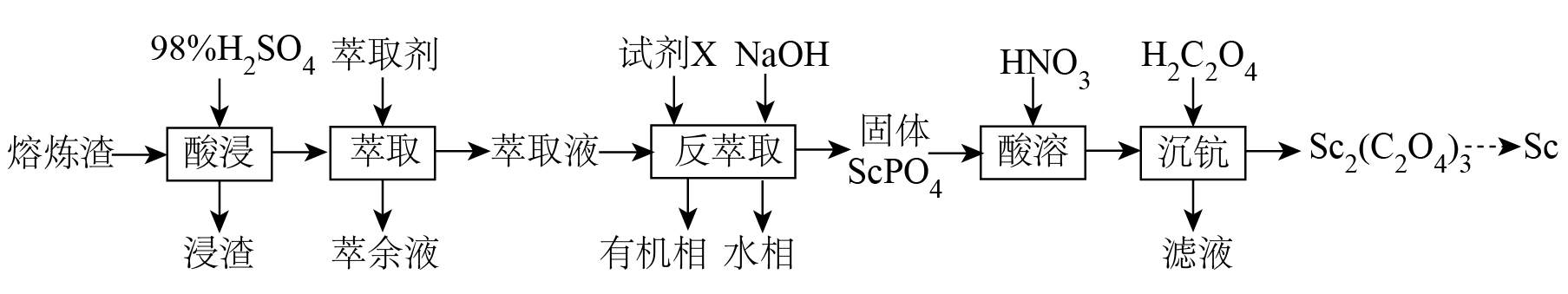
已知:①萃取剂为磷酸三丁酯、磷酸二丁酯和磺化煤油;②$\rm Sc^{3+}$的氧化性很弱。
回答下列问题:
“浸渣”的主要成分为 $\rm ($填化学式$\rm )$。
$\\rm CaSO_{4}$、$\\rm SiO_{2}$
"]]熔炼渣主要成分为$\rm Fe_{2}O_{3}$、$\rm SiO_{2}$、$\rm CaO$,少量$\rm Sc_{2}O_{3}$,其中二氧化硅不溶,氧化钙和硫酸反应生成硫酸钙,故“浸渣”的主要成分为$\rm CaSO_{4}$、$\rm SiO_{2}$;
“反萃取”的目的是分离$\rm Sc$和$\rm Fe$元素。向“萃取液”中加入$\rm NaOH$,$\rm (Fe^{2+}$、$\rm Fe^{3+}$、$\rm Sc^{3+})$的沉淀率随$\rm pH$的变化如图。试剂$\rm X$为 $\rm ($填$\rm Na_{2}SO_{3}$或$\rm NaClO)$,应调节$\rm pH$最佳为 。
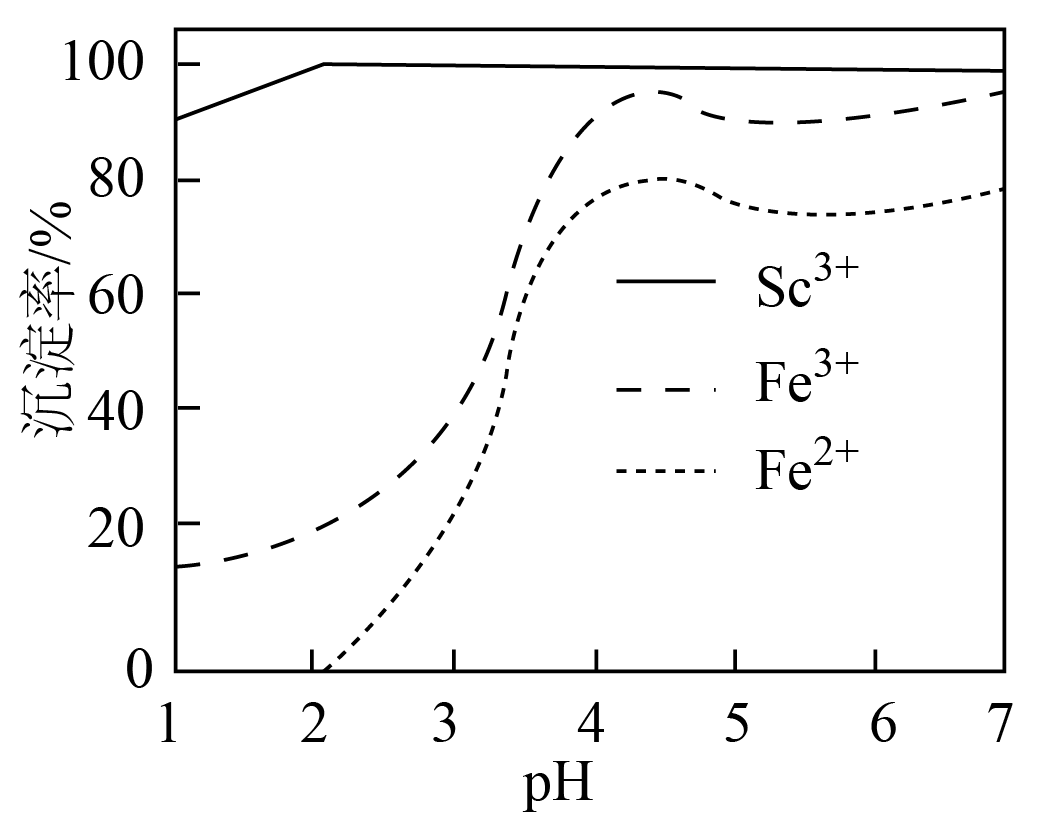
$\\rm Na_{2}SO_{3}$ ; $\\rm 2$
"]]由图可知,二价铁更容易和$\rm Sc$分离,故试剂$\rm X$应该是将三价铁转化为二价铁,则试剂$\rm X$为$\rm Na_{2}SO_{3}$;由图可知,$\rm pH$为$\rm 2$时,二价铁没有沉淀,$\rm Sc$的沉淀率已经很大,故应调节$\rm pH$最佳为$\rm 2$;
已知$\rm Sc_{2}(C_{2}O_{4})_{3}$难溶于水,难溶于酸;$ K_\rm {a1}(H_{2}C_{2}O_{4})=\textit{a}$,$K\rm_{a2}(H_{2}C_{2}O_{4})=\textit{b}$,$ K_\rm{sp}[Sc_{2}(C_{2}O_{4})_{3}]=\textit{c}$,“沉钪”时,发生反应:$\rm 2Sc^{3+}+3H_{2}C_{2}O_{4}=Sc_{2}(C_{2}O_{4})_{3\downarrow \rm }+6H^{+}$,此反应的平衡常数$ K=$ 。$\rm ($用含$a$、$b$、$c$代数式表示$\rm )$
$\\dfrac{\\textit{a}^{\\text{3}}\\textit{b}^{\\text{3}}}{\\textit{c}}$
"]]已知$ K_\rm{a1}(H_{2}C_{2}O_{4})=\textit{a}$,$ K_\text{a2}\rm(H_{2}C_{2}O_{4})=\textit{b}$,$ K_\rm {sp}[Sc_{2}(C_{2}O_{4})_{3}]=\textit{c}$,则结合平衡常数的定义可知反应$\rm 2Sc^{3+}+3H_{2}C_{2}O_{4}=Sc_{2}(C_{2}O_{4})_{3}+6H^{+}$的平衡常数$ K=\dfrac{{{[{{K}_\text{a1}}({{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}})\cdot {{K}_{\text{a2}}}\text{(}{{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{)}]}^{3}}}{{{K}_{\text{sp}}}[\text{S}{{\text{c}}_{\text{2}}}{{\text{(}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{)}}_{\text{3}}}]}\rm =\dfrac{{{\textit{a}}^{\text{3}}}{{\textit{b}}^{\text{3}}}}{\textit{c}}$;
$\rm Sc_{2}(C_{2}O_{4})_{3}$经系列操作可得$\text{ScC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$,$\text{ScC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$加热脱水时生成$\rm ScOCl$的化学方程式为 。
$\\rm ScCl_{3}·6H_{2}O\\begin{matrix} \\underline{\\underline{\\triangle }} \\\\ {} \\\\ \\end{matrix}\\rm ScOCl+2HCl↑+5H_{2}O$
"]]$\rm ScCl_{3}·6H_{2}O$沉淀在高温脱水的过程中,$\rm ScCl_{3}$发生了水解反应,方程式为:$\rm ScCl_{3}·6H_{2}O\begin{matrix} \underline{\underline{\triangle }} \\ {} \\ \end{matrix}\rm ScOCl+2HCl↑+5H_{2}O$;
在一定条件下,一种物质在两种互不相溶的溶剂$\rm A$、$\rm B$中的浓度之比是一个常数$\rm ($分配系数$ K_\rm d)$ ${{\textit{K}}_{\text{d}}}=\dfrac{\textit{c}(\rm A)}{\textit{c}(\rm B)}$;萃取率$\rm =\dfrac{{{\textit{n}}_{有机物}}\text{(X)}}{{{\textit{n}}_{总}}\text{(X)}}\times 100\%$。萃取$\rm Sc$的过程中,若$\rm Sc$元素的分配系数${{\textit{K}}_{\text{d}}}=\dfrac{\textit{c}(有机相\text{)}}{\textit{c}(水相\text{)}}=7.5$,取$\rm 100\;\rm mL$含钪的溶液,一次性加入$\rm 60\;\rm mL$萃取剂,则$\rm Sc$的萃取率为 $\rm \%($保留到小数点后一位,下同$\rm )$;若将$\rm 60\;\rm mL$萃取剂分成$\rm 3$次萃取,每次用$\rm 20\;\rm mL$,则最后一次水层中钪的残留率为 $\rm \%$。
$\\rm 81.8$ ; $\\rm 6.4$
"]]设$\rm 100\;\rm mL$含$\rm Sc$的溶液中$\rm Sc$的物质的量为$a$ $\rm mol$,一次性加入$\rm 60\;\rm mL$萃取剂,其中可以萃取的$\rm Sc$的物质的量为$ x\rm\ mol$,则${{\textit{K}}_{\text{d}}}=\dfrac{\dfrac{\textit{x}}{60\times {{10}^{-3}}}}{\dfrac{a-x}{100\times {{10}^{-3}}}}=7.5$,解得$ x=0.818a$,$\rm Sc$的萃取率$\rm =\dfrac{\textit{n}_{有机物}\text{(X)}}{\textit{n}_{总}\text{(X)}}\times100\%=\dfrac{\text{0.818}\textit{a}}{\textit{a}}\times100\%=81.8\%$;
若将$\rm 60\;\rm mL$萃取剂分成$\rm 3$次萃取,每次用$\rm 20\;\rm mL$,设$\rm 100\;\rm mL$含$\rm Sc$的溶液中$\rm Sc$的物质的量为$a$ $\rm mol$,一次性加入$\rm 20\;\rm mL$萃取剂,其中可以萃取的$\rm Sc$的物质的量为$ x\rm\ mol$,则${{\textit{K}}_{\text{d}}}=\dfrac{\dfrac{\textit{x}}{20\times {{10}^{-3}}}}{\dfrac{a-x}{100\times {{10}^{-3}}}}=7.5$,解得$ x=0.6a$,$\rm Sc$的萃取率$\rm =\dfrac{{{\textit{n}}_{有机物}}\text{(X)}}{{{\textit{n}}_{总}}\text{(X)}}\times 100\%=\dfrac{0.6\textit{a}}{\textit{a}}\times 100\%=60\%$,钪的残留率为$\rm 1-60\%=40\%$,没有每次萃取时,使用的萃取剂体积都是$\rm 20\;\rm mL$,则每次的萃取率相同,故最后一次水层中钪的残留率$\rm =40\%\times 40\%\times 40\%=6.4\%$。
高中 | 化学平衡常数题目答案及解析(完整版)
