高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
二氧化碳资源化利用,涉及主要反应如下:
$\rm I$.$\text{C}\text{O}_{2}\left( \text{g}\right)+\text{H}_{2}\left( \text{g}\right)\rightleftharpoons\text{CO}\left( \text{g}\right)+\text{H}_{2}\text{O}\left( \text{g}\right)\qquad\Delta H_{1}=+41.2\ \text{kJ}\cdot\text{mo}\text{l}^{-1}$
$\rm I$$\rm I$.$\text{C}\text{O}_{2}\left( \text{g}\right)+4\text{H}_{2}\left( \text{g}\right)\rightleftharpoons\text{C}\text{H}_{4}\left( \text{g}\right)+2\text{H}_{2}\text{O}\left( \text{g}\right)\qquad\Delta H_{2}=-144.9\ \text{kJ}\cdot\text{mo}\text{l}^{-1}$
回答下列问题:
$2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$的焓变$\Delta H=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm I$的净速率$v={{v}_{正}}-{{v}_{逆}}={{k}_{正}}\cdot c\left( \text{C}{{\text{O}}_{2}} \right)\cdot c\left( {{\text{H}}_{2}} \right)-{{k}_{逆}}\cdot c\left( {{\text{H}}_{2}}\text{O} \right)\cdot c\left( \text{CO} \right)$,其中${{k}_{正}}$、${{k}_{逆}}$分别为正、逆反应速率常数。升高温度时,${{k}_{正}}-{{k}_{逆}}$ $\rm ($填“增大”、“减小”或“不变”$\rm )$。
$-227.3$ ;增大
"]]根据盖斯定律,反应$\rm II-$反应$\rm I\times 2$可得$2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$,$\Delta H=-144.9\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}-(+41.2\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times 2\rm) =-227.3\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;反应$\rm I$正反应吸热,升高温度,平衡正向移动,$\textit{k}_{正}-\textit{k}_{逆}$增大;
分别向压强为$0.1\ \text{MPa}$、$1.0\ \text{MPa}$的恒压体系中通入$1\ \text{mol\ C}\text{O}_{2}\left( \text{g}\right)$和$4\;\rm \text{mol}\ {{\text{H}}_{2}}\left( \text{g} \right)$,达平衡时,部分含碳物种的摩尔分数$\eta \left( X \right)=\dfrac{n\left( X \right)}{n\left( \text{C}{{\text{H}}_{4}} \right)+n\left( \text{CO} \right)+n\left( \text{C}{{\text{O}}_{2}} \right)}$随温度变化如图所示。
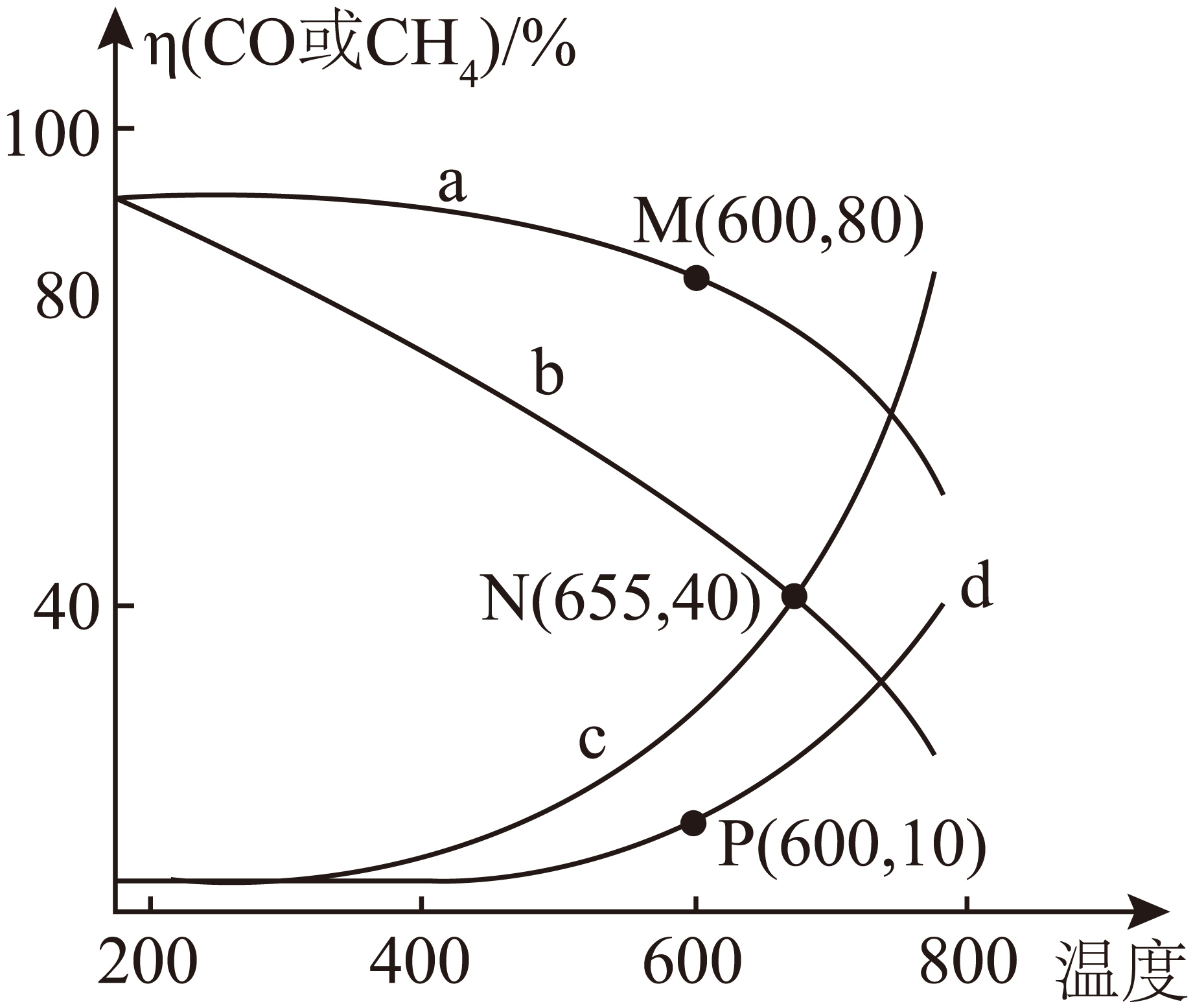
表示压强为$1.0\ \text{MPa}$时,$\text{CO}\left( \text{g} \right)$的摩尔分数随温度变化的曲线是 $\rm ($填标号$\rm )$。随温度升高,当温度高于$\rm 655\;\rm ^\circ\rm C$,对应含碳物种的摩尔分数$\eta \left( \text{b} \right)\lt \eta \left( \text{c} \right)$的原因是 。
$\\rm d$ ;升高温度,促进反应$\\rm I$正向进行,抑制反应$\\rm II$,低温时,以反应$\\rm II$为主,高于$\\rm 655\\;\\rm ^\\circ\\rm C$,以反应$\\rm I$为主
"]]升高温度,反应$\rm I$平衡正向移动,反应$\rm II$平衡逆向移动,$\eta \left( \text{CO} \right)$增大,$\eta \left( \text{C}{{\text{H}}_{4}} \right)$减小,增大压强,反应$\rm II$平衡正向移动,$\eta \left( \text{C}{{\text{H}}_{4}} \right)$增大,$\eta \left( \text{CO} \right)$减小,则压强为$1.0\ \text{MPa}$时,$\text{CO}\left( \text{g} \right)$、$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$的摩尔分数随温度变化的曲线分别是$\rm d$、$\rm a$;则压强为$0.1\ \text{MPa}$时,$\text{CO}\left( \text{g} \right)$、$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$的摩尔分数随温度变化的曲线分别是$\rm c$、$\rm b$;表示压强为$1.0\ \text{MPa}$时,$\text{CO}\left( \text{g} \right)$的摩尔分数随温度变化的曲线是$\rm d$;
温度升高,当温度高于$\rm 655\;\rm ^\circ\rm C$,对应含碳物种的摩尔分数$\eta \left( \text{b} \right)\lt \eta \left( \text{c} \right)$的原因是:升高温度,促进反应$\rm I$正向进行,抑制反应$\rm II$,低温时,以反应$\rm II$为主,高于$\rm 655\;\rm ^\circ\rm C$,以反应$\rm I$为主;
图示$\rm M$、$\rm N$、$\rm P$三点对应$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的转化率大小关系为 ;$\rm 655\;\rm ^\circ\rm C$时,反应$\rm I$的平衡常数${{K}_{\text{p}}}=$ ;$\rm 600\;\rm ^\circ\rm C$,压强为$1.0\ \text{MPa}$时,若增大投料比$\dfrac{n\left( {{\text{H}}_{2}} \right)}{n\left( \text{C}{{\text{O}}_{2}} \right)}$,重新达平衡后,$\dfrac{n\left( \text{CO} \right)}{n\left( \text{C}{{\text{H}}_{4}} \right)}$的值将 $\rm ($填“增大”、“减小”或“不变”$\rm )$。
$\\text{M}=\\text{P}\\gt \\text{N}$ ;$\\rm 1.2$; 减小
"]]根据$(2)$中分析,$\rm M$、$\rm P$两点温度相同,压强相同,$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的转化率相同,$\eta \left( \text{C}{{\text{H}}_{4}} \right)$为$\rm 80\%$,$\eta \left( \text{CO} \right)$为$\rm 10\%$,则$\text{ }\!\!\eta\left( \text{C}{{\text{O}}_{2}} \right)$为$\rm 10\%$,$\rm N$点$\eta\left( \text{C}{{\text{H}}_{4}} \right)$为$\rm 40\%$,$\eta \left( \text{CO} \right)$为$\rm 40\%$,则$\eta\left( \text{C}{{\text{O}}_{2}} \right)$为$\rm 20\%$,说明$\rm N$点$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的转化率较小,$\rm M$、$\rm N$、$\rm P$三点对应$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的转化率大小关系为:$\text{M}=\text{P}\gt \text{N}$;
根据碳原子守恒,$\rm 655\;\rm ^\circ\rm C$时,$\rm N$点$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$、$\text{CO}\left( \text{g} \right)$、$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$分别为$\rm 0.2\;\rm mol$、$\rm 0.4\;\rm mol$、$\rm 0.4\;\rm mol$;根据反应$\rm I$.$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$、$\rm I$$\rm I$.$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$反应共消耗${{\text{H}}_{2}}\left( \text{g} \right)$为$\rm 0.4\;\rm mol+0.4\;\rm mol\times 4=2\;\rm mol$,余下${{\text{H}}_{2}}\left( \text{g} \right)\ \rm 2\;\rm mol$,生成${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$为$\rm 0.4\;\rm mol+0.4\;\rm mol\times 2=1.2\;\rm mol$,此时体系内气体总的物质的量为$\rm (0.2+0.4+0.4+2+1.2)=4.2\;\rm mol$,$\rm 655\;\rm ^\circ\rm C$时,$\rm N$点压强为$0.1\ \text{MPa}$,则$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$、${{\text{H}}_{2}}\left( \text{g} \right)$、$\text{CO}\left( \text{g} \right)$、${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$的分压分别为$\dfrac{0.2}{4.2}\times0.1\ \text{MPa}$、$\dfrac{2}{4.2}\times0.1\ \text{MPa}$、$\dfrac{0.4}{4.2}\times0.1\ \text{MPa}$、$\dfrac{1.2}{4.2}\times0.1\ \text{MPa}$,反应$\rm I$的平衡常数${{K}_{\text{p}}}=\dfrac{\textit{P}(\text{CO})\cdot \textit{P}({{\text{H}}_{2}}\text{O})}{\textit{P}(\text{C}{{\text{O}}_{2}})\cdot \textit{P}({{\text{H}}_{2}})}\rm =\dfrac{0.4\times 1.2}{0.2\times 2}\rm =1.2$;
$\rm 600\;\rm ^\circ\rm C$,压强为$1.0\ \text{MPa}$时,若增大投料比$\dfrac{n\left( {{\text{H}}_{2}} \right)}{n\left( \text{C}{{\text{O}}_{2}} \right)}$,$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的转化率变大,根据图像中$\rm a$、$\rm d$两条曲线可知,$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$增多,$\text{CO}\left( \text{g} \right)$减少,则重新达平衡后,$\dfrac{n\left( \text{CO} \right)}{n\left( \text{C}{{\text{H}}_{4}} \right)}$的值将减小。
高中 | 化学平衡常数题目答案及解析(完整版)
