高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
在$\rm 550\ K$~$\rm 650\ K$,反应$2\text{M}(\text{g})+\text{N}(\text{g})\rightleftharpoons2\text{P}(\text{g})+2\text{Q}(\text{g})\qquad\Delta H\lt0$温度升高反应速率显著加快。在$\rm (573\ K$,$\rm 150\;\rm kPa)$、$\rm (573\ K$,$\rm 300\;\rm kPa)$、$\rm (553\ K$,$\rm 150\;\rm kPa)$三种初始状态下,向相同恒容密闭容器中分别按$n(\text{M}):n(\text{N})=2:1$投料,保持温度不变,$\dfrac{n(\text{P})/n(\text{M})}{[n(\text{P})/n(\text{M})]\max }$随时间变化如图。曲线$\rm a$的$\rm M$平衡转化率${{\alpha }_{平}}(\text{M})=25\%$,曲线$b$对应初始状态为$\rm (573\ K$,$\rm 300\;\rm kPa)$。下列说法正确的是$(\qquad)$
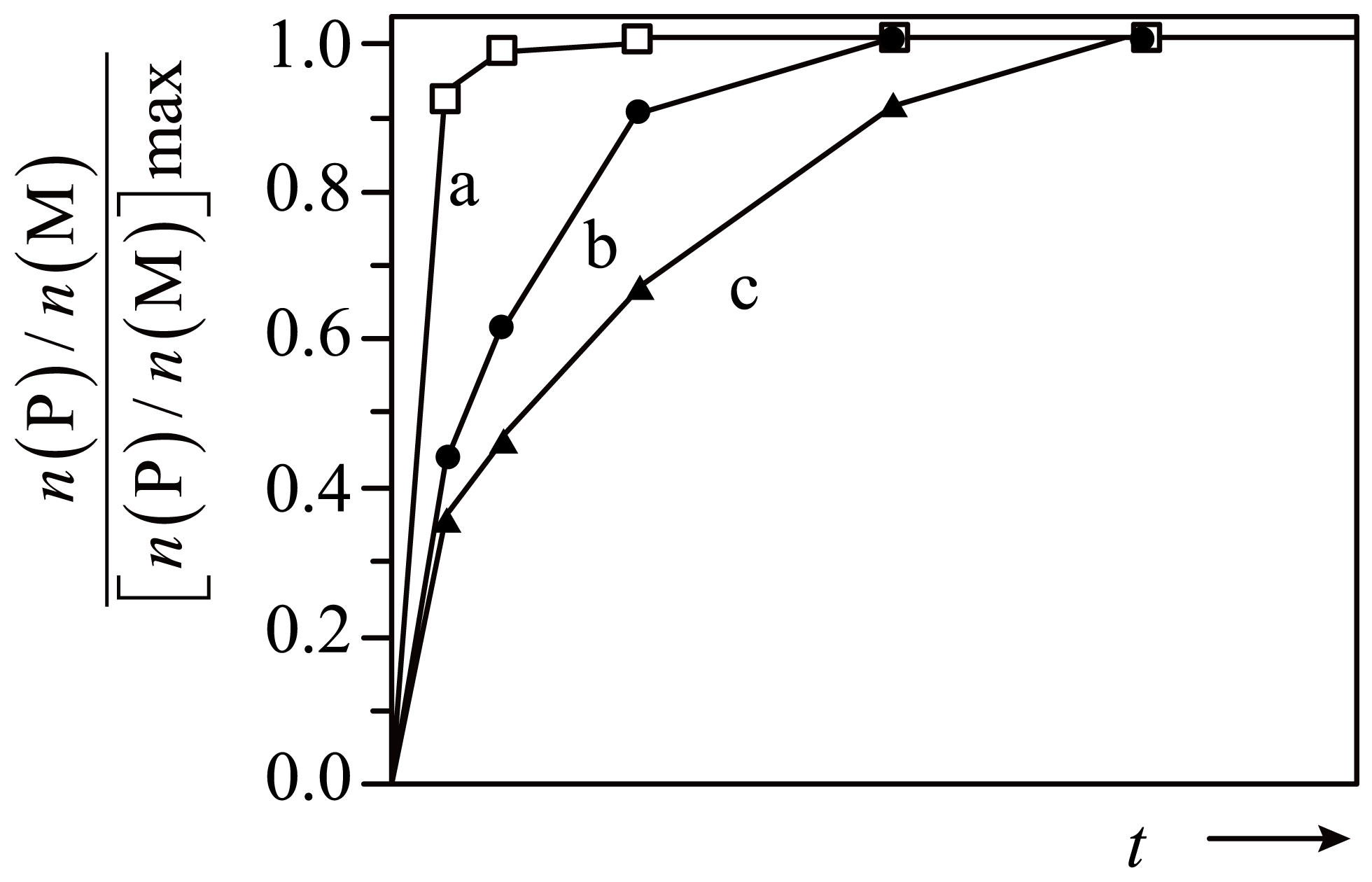
曲线$\\rm c$对应初始状态为$\\rm (573\\ K$,$\\rm 150\\;\\rm kPa)$
","在$\\rm 573\\ K$下,该反应的平衡常数${{K}_{P}}=0.185\\;\\rm \\text{kPa}$
","${{[n(\\text{P})/n(\\text{M})]}_{\\text{max}}}$最大的是曲线$\\rm a$
","对应曲线$\\rm a$初始状态下,保持恒温恒压,则${{\\alpha }_{平}}\\left( \\text{M} \\right)\\gt 25\\%$
"]$\rm A$.曲线$\rm b$对应初始状态为$\rm (573\ K$,$\rm 300\;\rm kPa)$,$\rm (553\ K$,$\rm 150\;\rm kPa)$和$\rm (573\ K$,$\rm 150\;\rm kPa)$相比,$\rm (573\ K$,$\rm 150\;\rm kPa)$温度更高,$\rm (573\ K$,$\rm 150\;\rm kPa)$时先达到平衡,图像显示,曲线$\rm a$先平衡,则曲线$\rm c$对应初始状态为$\rm (553\ K$,$\rm 150\;\rm kPa)$ ,$\rm A$错误;
$\rm B$.设起始时$ n\rm(M)=2\;\rm mol$,$ n\rm(N)$ $\rm =$ $\rm 1\;\rm mol$ ,曲线$\rm a$的$\rm M$平衡转化率${{\alpha}_{平}}\text{(M)=25 }\!\!\%$,则平衡时$\textit{n}{\rm(M)=2\ mol}\times \text{(1-25 }\!\!\%\!\!\text{ )=1}\text{.5\ mol}$,$\textit{n}{\rm(N)=1\ mol-2\ mol}\times \text{25 }\!\!\%\times \dfrac{\text{1}}{\text{2}}\text{=0}\text{.75\ mol}$,$\textit{n}{\rm(P)=\textit{n}(Q)=2\ mol}\times \text{25 }\!\!\%\!\!\text{ =0}\text{.5\ mol}$,总物质的量${{\textit{n}}_{总}}\text{=1}\text{.5\ mol + 0}\text{.75\ mol+0}\text{.5\ mol + 0}\text{.5\ mol=3}\text{.25\ mol}$,该反应在恒容密闭容器中进行,根据$\textit{p}{ = }{cRT}$($ R$、$ T$、$ V$不变),分压之比等于物质的量之比,$\textit{p}{\rm(M)=}\dfrac{\text{1}\text{.5\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa}$,$\textit{p}{\rm(N)=}\dfrac{\text{0}\text{.75\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa}$,$\textit{p}{\rm(P)=}{\textit{p}}{\rm(Q)=}\dfrac{\text{0}\text{.5\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa}$;平衡常数${{\textit{K}}_{\text{p}}}=\dfrac{{{\textit{p}}^{\text{2}}}\text{(P)}\times {{\textit{p}}^{\text{2}}}\text{(Q)}}{{{\textit{p}}^{\text{2}}}\text{(M)}\times \textit{p}{\rm(N)}}=\dfrac{{{\text{(}\dfrac{\text{0}\text{.5\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa)}}^{\text{2}}}\times {{\text{(}\dfrac{\text{0}\text{.5\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa)}}^{\text{2}}}}{{{\text{(}\dfrac{\text{1}\text{.5\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa)}}^{\text{2}}}\times \dfrac{\text{0}\text{.75\ mol}}{\text{3}\text{.25\ mol}}\times \text{150\ kPa}}\ne \text{0}\text{.185\ kPa}$,$\rm B$错误;
$\rm C$.由反应特点可知,温度不变时,压强越小,平衡正向进行程度越大,压强相同时、温度越低,平衡正向进行程度越大,即温度越低、压强越小,${{\left[ \textit{n}\left( \text{P} \right)/\textit{n}\left( \text{M} \right) \right]}_{\text{max}}}$越大,曲线$\rm c$对应$\rm (553\ K$,$\rm 150\;\rm kPa)$,所以${{\left[ \textit{n}\left( \text{P} \right)/\textit{n}\left( \text{M} \right) \right]}_{\text{max}}}$最大的是曲线$\rm c$,$\rm C$错误;
$\rm D$.由$\rm a$项分析可知,对应曲线$\rm a$初始状态$\rm (573\ K$,$\rm 150\;\rm kPa)$ ,该反应正方向气体物质的量减小,恒温恒压下,相当于在原平衡基础上减压,减压平衡正向移动,${{\alpha}_{平}}\text{(M)>25 }\!\!\%$,$\rm D$错误;
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
