高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
将$\rm CO_{2}$转化为二甲醚的反应原理为$\rm 2CO_{2}(g)+6H_{2}(g)$ $\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm CH_{3}OCH_{3}(g)+3H_{2}O(g)$,一定条件下,现有两个体积均为$\rm 1.0$ $\rm L$的恒容密闭容器甲和乙,在甲中充入$\rm 0.1$ $\rm mol$ $\rm CO_{2}$和$\rm 0.18$ $\rm mol$ $\rm H_{2}$,在乙中充入$\rm 0.2$ $\rm mol$ $\rm CO_{2}$和$\rm 0.36$ $\rm mol$ $\rm H_{2}$,发生上述反应并达到平衡。该反应中$\rm CO_{2}$的平衡转化率随温度的变化曲线如图所示。下列说法正确的是$(\qquad)$
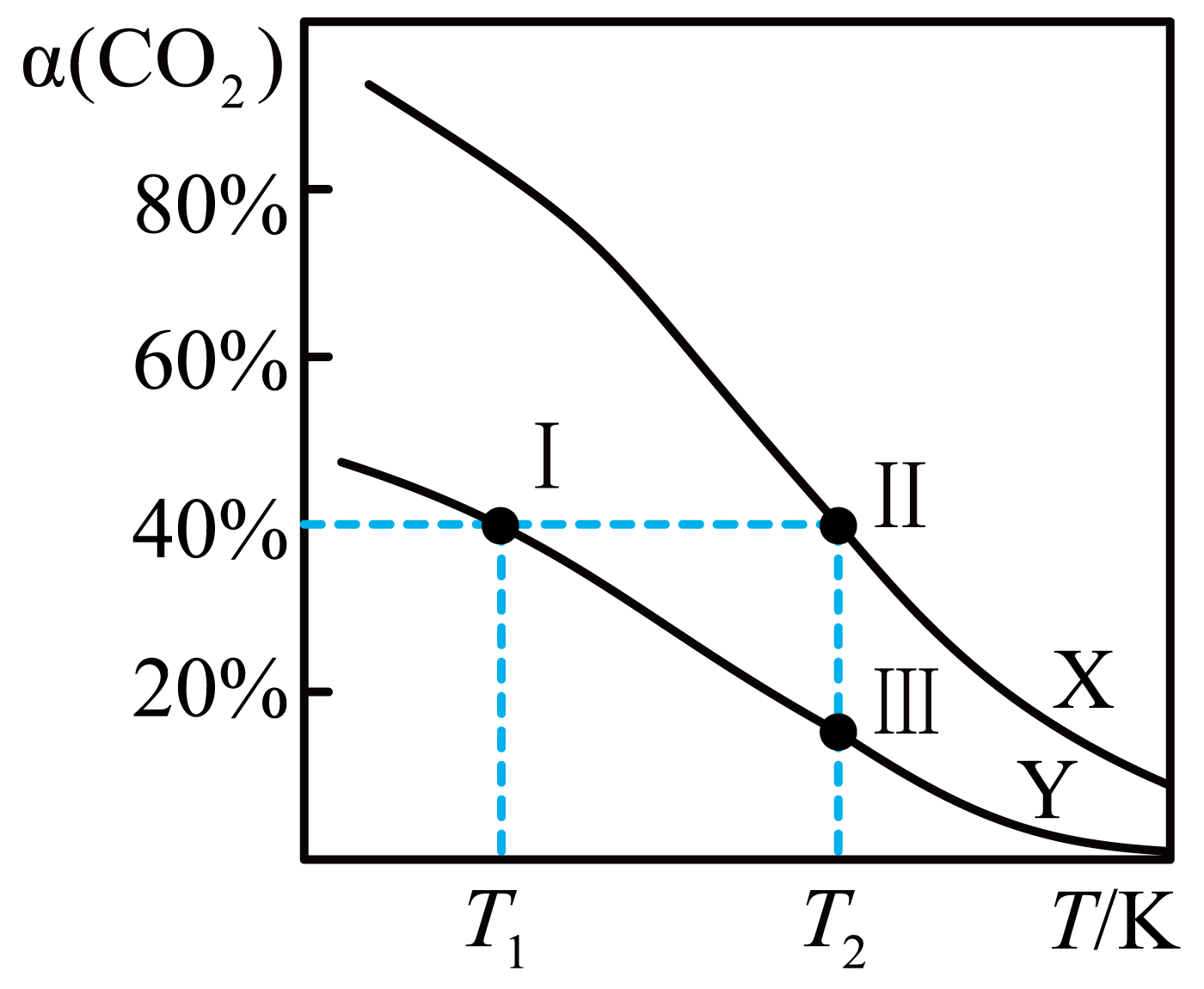
曲线$\\rm X$表示的是容器甲中$\\rm CO_{2}$的平衡转化率随温度的变化
","体系的总压强$P_{总}$:$P_{总}($状态Ⅱ$)\\lt2P_{总}($状态Ⅲ$\\rm )$
","将状态Ⅰ对应的容器升温到$T_{2}\\rm\\ K$,可变成状态Ⅱ
","$T_{2}$ $\\rm K$时,向空的容器甲中充入$\\rm CO_{2}(g)$、$\\rm H_{2}(g)$、$\\rm CH_{3}OCH_{3}(g)$和$\\rm H_{2}O(g)$各$\\rm 1\\;\\rm mol$,反应将向正方向进行
"]$\rm A\rm .$由已知,结合图象可得,恒温恒容时,甲、乙两平衡不等效,由于正反应是气体分子数减少的瓜不,故压强越大反应物的转化率越高。在相同温度下,乙的$\rm CO_{2}$的平衡转化率高,所以曲线$\rm X$表示的是容器乙中$\rm CO_{2}$的平衡转化率随温度的变化,选项$\rm A$错误;
$\rm B\rm .$状态$\rm II$和状态$\rm III$温度和体积相同,点$\rm II$处于起始加入$\rm 0.2\;\rm mol\;\rm CO_{2}$的曲线上,点$\rm III$处于起始加入$\rm 0.1\;\rm mol\;\rm CO_{2}$的曲线上,状态$\rm II$起始加入的$\rm CO_{2}$物质的量是状态$\rm III$的两倍,状态$\rm II$相当于在状态$\rm III$达平衡后将体积缩小一半,若平衡不移动,状态$\rm II$总压强等于状态$\rm III$的两倍,增大压强平衡向正反应方向移动,所以$P_{总}$(状态$\rm II$)$\lt2P_{总}$(状态$\rm III$),选项$\rm B$正确;
$\rm C\rm .$ 由图象可知,将状态Ⅰ对应的容器升温到$T_{2}\rm\ K$,平衡逆向移动,$\rm CO_{2}$的平衡转化率减小,只能得到状态$\rm III$而得不到状态$\rm II$,选项$\rm C$错误;
$\rm D\rm .$ $T_{2}$ $\rm K$时,乙中$\rm CO_{2}$的平衡转化率$\rm 40\%$,平衡时$\rm CO_{2}(g)$、$\rm H_{2}(g)$、$\rm CH_{3}OCH_{3}(g)$和$\rm H_{2}O(g)$的浓度分别为$\rm 0.12\;\rm mol/L$、$\rm 0.12\;\rm mol/L$、$\rm 0.04\;\rm mol/L$、$\rm 0.12\;\rm mol/L$,$K=\dfrac{0.04\times0.12^{3}}{0.12^{2}\times0.12^{6}}=1607.5$,在相同温度下,化学平衡常数不变。向空的容器甲中充入$\rm CO_{2}(g)$、$\rm H_{2}(g)$、$\rm CH_{3}OCH_{3}(g)$和$\rm H_{2}O(g)$各$\rm 1\;\rm mol$,$Q=\dfrac{1\times1^{3}}{1^{2}\times1^{6}}=1\lt1607.5$,反应将向正方向进行,选项$\rm D$正确。
故选:$\rm BD$
高中 | 化学平衡常数题目答案及解析(完整版)
