高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
一种从深海多金属结核$\rm [$主要含$\text{Mn}{{\text{O}}_{2}}$、$\text{FeO}(\text{OH})$、$\text{Si}{{\text{O}}_{2}}$,有少量的$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$、$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$、$\text{NiO}$、$\text{CuO}\rm ]$中分离获得金属资源和电池级镍钴锰混合溶液$ ( \text{NiS}{{\text{O}}_{4}}$、$\text{CoS}{{\text{O}}_{4}} $、$\text{MnS}{{\text{O}}_{4}} )$的工艺流程如下:
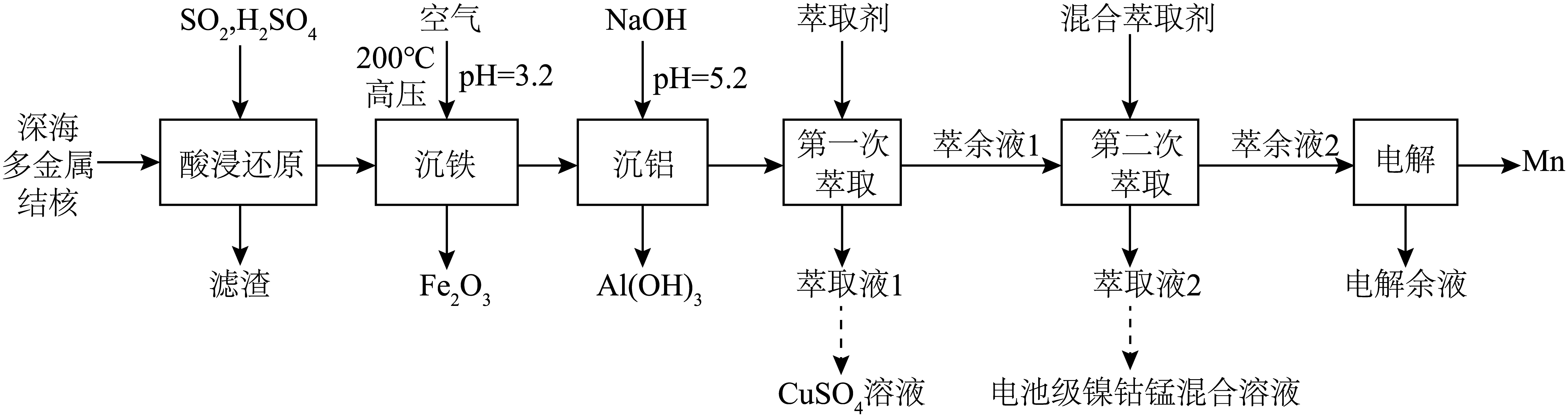
已知:①金属氢氧化物胶体具有吸附性,可吸附金属阳离子。
②常温下,溶液中金属离子$\rm ($假定浓度均为$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\rm )$开始沉淀和完全沉淀$\left( {c}\leqslant 1.0\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}} \right)$的$\text{pH}$:
| $\text{F}{{\text{e}}^{3+}}$ | $\text{A}{{\text{l}}^{3+}}$ | $\text{C}{{\text{u}}^{2+}}$ | $\text{N}{{\text{i}}^{2+}}$ | $\text{C}{{\text{o}}^{2+}}$ | $\text{M}{{\text{n}}^{2+}}$ | |
| 开始沉淀的$\text{pH}$ | $\rm 1.9$ | $\rm 3.3$ | $\rm 4.7$ | $\rm 6.9$ | $\rm 7.4$ | $\rm 8.1$ |
| 完全沉淀的$\text{pH}$ | $\rm 3.2$ | $\rm 4.6$ | $\rm 6.7$ | $\rm 8.9$ | $\rm 9.4$ | $\rm 10.1$ |
回答下列问题:
基态$\text{Ni}$的价层电子排布式为 。
$\\text{3}{{\\text{d}}^{\\text{8}}}\\text{4}{{\\text{s}}^{\\text{2}}}$
"]]$\text{Ni}$原子的价电子是指$\text{3d}$和$\text{4s}$能级上的电子,所以基态$\text{Ni}$原子的价电子排布式为$\text{3}{{\text{d}}^{\text{8}}}\text{4}{{\text{s}}^{\text{2}}}$;
“酸浸还原”时,“滤渣”的主要成分是 $\rm ($写化学式$\rm )$;$\rm \text{S}{{\text{O}}_{2}}$还原$\rm \text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$的化学方程式为 。
$\\rm \\text{Si}{{\\text{O}}_{2}}$;$\\rm S{{O}_{2}}+C{{o}_{2}}{{\\text{O}}_{3}}+{{\\text{H}}_{2}}S{{O}_{4}}=2CoS{{O}_{4}}+{{\\text{H}}_{2}}\\text{O}$
"]]由分析可知,“酸浸还原”时,“滤渣”的主要成分是$\rm \text{Si}{{\text{O}}_{2}}$;$\rm \text{S}{{\text{O}}_{2}}$将$\rm 3$价钴还原为$\rm 2$价钴,同时由于硫酸的作用得到$\rm CoS{{O}_{4}}$,化学方程式为$\rm S{{O}_{2}}+C{{o}_{2}}{{\text{O}}_{3}}+{{\text{H}}_{2}}S{{O}_{4}}=2CoS{{O}_{4}}+{{\text{H}}_{2}}\text{O}$;
“沉铁”时,$\text{F}{{\text{e}}^{2+}}$转化为$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$的离子方程式为 ,加热至$200\;^\circ \rm C$的主要原因是 。
$\\text{4F}{{\\text{e}}^{2+}}+{{\\text{O}}_{2}}\\text{+4}{{\\text{H}}_{2}}\\text{O}\\begin{matrix} \\underline{\\underline{高压}} \\\\ 200\\;^\\circ \\rm C \\\\ \\end{matrix}\\text{2F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}\\text{+8}{{\\text{H}}^{+}}$;防止形成$\\text{Fe(OH}{{\\text{)}}_{\\text{3}}}$胶体,防止其吸附其他金属阳离子,造成产率下降
"]]“沉铁”时,$\text{F}{{\text{e}}^{2+}}$转化为$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$,铁元素化合价上升,则${{\text{O}}_{\text{2}}}$做氧化剂,离子反应为:$\text{4F}{{\text{e}}^{2+}}+{{\text{O}}_{2}}\text{+4}{{\text{H}}_{2}}\text{O}\begin{matrix} \underline{\underline{高压}} \\ 200\;^\circ \rm C \\ \end{matrix}\text{2F}{{\text{e}}_{2}}{{\text{O}}_{3}}\text{+8}{{\text{H}}^{+}}$;已知金属氢氧化物胶体具有吸附性,可吸附金属阳离子,则加热至$200\;^\circ \rm C$的主要原因是防止形成$\text{Fe(OH}{{\text{)}}_{\text{3}}}$胶体,防止其吸附其他金属阳离子,造成产率下降;
“沉铝”时,未产生$\text{Cu}{{(\text{OH})}_{2}}$沉淀,该溶液中$ {c}\left( \text{C}{{\text{u}}^{2+}} \right)$不超过 $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
$1\\times {{10}^{-2}}$
"]]由表可知,${{ {K}}_\rm{sp}}\left[\rm Cu{{\left( OH \right)}_{2}} \right]=1.0\times {{10}^{-5}}\;\rm mol/\text{L}\times {{\left( \dfrac{{{10}^{-14}}}{{{10}^{-6.7}}} \right)}^{2}}={{10}^{-19.6}}$,“沉铝”时,未产生$\text{Cu}{{(\text{OH})}_{2}}$沉淀,则$ {c}\left(\rm C{{u}^{2+}} \right)\lt \dfrac{{{ {K}}_{\rm sp}}\left[ \rm Cu{{\left( OH \right)}_{2}} \right]}{{{ {c}}^{2}}\left(\rm O{{H}^{-}} \right)}=\dfrac{{{10}^{-19.6}}}{{{\left( {{10}^{-8.8}} \right)}^{2}}}\;\rm mol/\text{L}=1\times {{10}^{-2}}\;\rm mol/\text{L}$;
“第二次萃取”时, 、 $\rm ($填离子符号$\rm )$与混合萃取剂形成的配合物$\rm ($其结构如图所示,$\rm M$表示金属元素$\rm )$更稳定,这些配合物中氮原子的杂化类型为 。
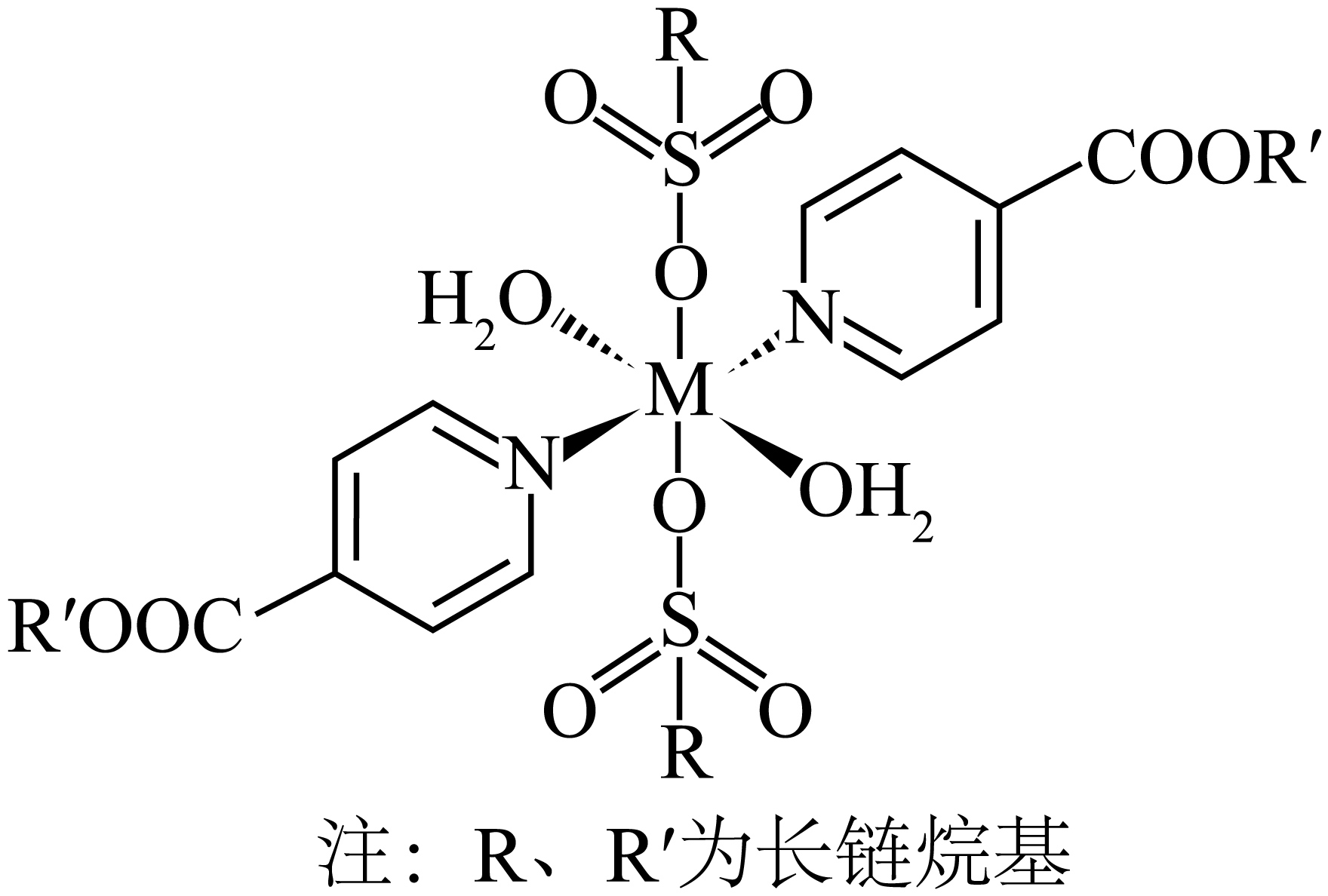
$\\rm C{{o}^{2+}}$;$\\rm N{{i}^{2+}}$;$\\rm sp^{2}$
"]]由流程可知,第二次萃取时,主要萃取$\rm C{{o}^{2+}}$、$\rm N{{i}^{2+}}$,因此$\rm C{{o}^{2+}}$、$\rm N{{i}^{2+}}$与混合萃取剂形成的配合物更稳定;六元杂环是平面结构,$\rm N$原子提供单电子用于环内形成$\rm \mathop{\prod }_{6}^{6}$大$\rm \pi$键,剩余$\rm 1$对孤对电子形成配位键,$\rm N$的价层电子对数为$\rm 3$,是$\rm sp^{2}$杂化。
高中 | 杂化轨道理论题目答案及解析(完整版)
