高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
铜元素在生命体系和超导领域研究中发挥着至关重要的作用。回答下列问题。
基态$\rm Cu$原子价层电子排布式为 。
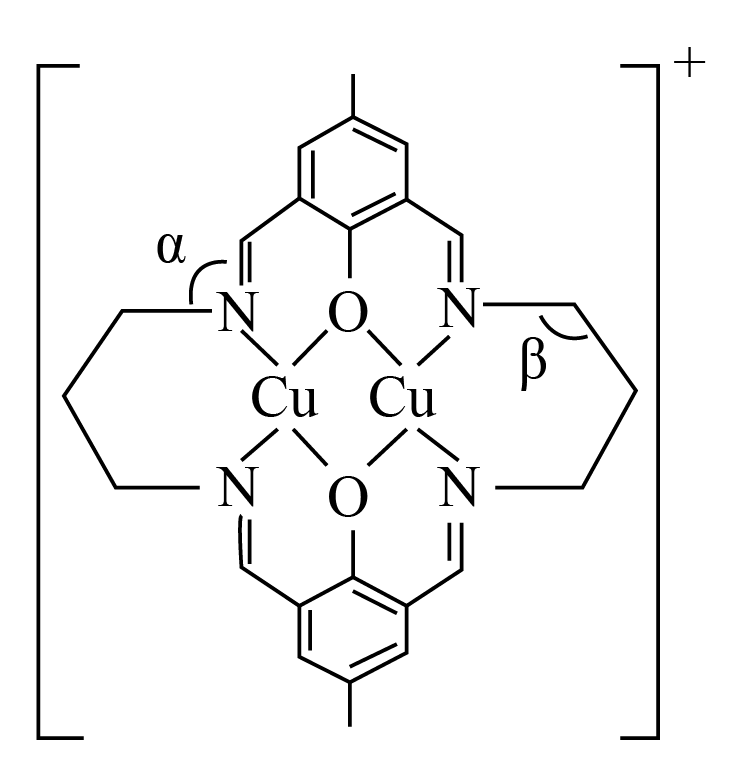
双核铜物种存在于色素细胞中,某大环双核铜配合物的配离子结构如图。
$\\text{3}{{\\text{d}}^{\\text{10}}}\\text{4}{{\\text{s}}^{\\text{1}}}$
"]]基态$\rm Cu$原子核外$\rm 29$个电子,电子排布式为$\text{ }\!\![\!\!\text{ Ar }\!\!]\!\!\text{ 3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$,价层电子排布式为$\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$
该配离子中所含第二周期元素的基态原子第一电离能由大到小的顺序为 。
$\\rm N\\gt O\\gt C$
"]]该配离子中所含第二周期元素有$\rm N$、$\rm O$、$\rm C$,同一周期从左到右第一电离能有增大的趋势,其中第$\rm IIA$,$\rm VA$元素第一电离能大于同周期相邻元素的第一电离能,故基态原子第一电离能:$\rm N\gt O\gt C$
$\rm Cu$的化合价为 。
$\\rm +1$、$\\rm +2$
"]]配离子中心原子$\rm Cu$与$\rm 4$个$\rm N$形成的配位键中的电子均来自$\rm N$原子的孤电子对和$\rm RO^{-}$的$\rm O$的孤电子对,离子带一个正电荷,故两个$\rm Cu$原子$\rm 1$个为$\rm +1$价,$\rm 1$个为$\rm +2$价
键角$\rm \alpha$ $\rm \beta($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$、解释原因 。
$\\rm \\gt $ ;中心原子$\\text{N}$为$\\text{s}{{\\text{p}}^{2}}$杂化,$\\text{C}$为$\\text{s}{{\\text{p}}^{3}}$杂化
"]]$\rm N=C$中$\rm N$原子采取$\rm sp^{2}$杂化,饱和碳原子采取$\rm sp^{3}$杂化,使得键角$\rm \alpha\gt \beta$
$\text{N}{{\text{H}}_{3}}$和氨硼烷$\left( \text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}} \right)$均可与金属$\text{Na}$反应表现出一定的酸性。
酸性:$\text{N}{{\text{H}}_{3}}$ $\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。一定条件下等物质的量$\text{Na}$与$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$反应的化学方程式为 。
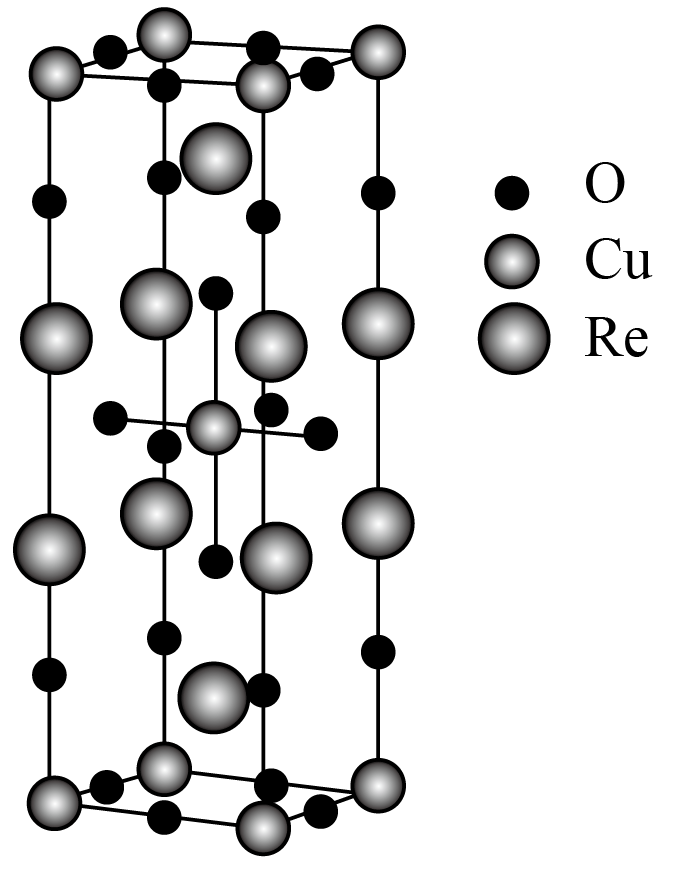
某电子型含铜化合物可用于超导材料,结构如图。
$\\rm \\lt $; $\\text{2Na+2N}\\text{H}_{\\text{3}}\\text{B}\\text{H}_{3}\\begin{matrix}\\underline{\\underline{ 一定条件}}\\\\\\\\\\end{matrix}\\text{2B}\\text{H}_{3}\\text{N}\\text{H}_{\\text{2}}\\text{Na+}\\text{H}_{\\text{2}}\\uparrow$
"]]$\text{N}{{\text{H}}_{3}}$分子中$\rm N$原子有一对孤电子对,$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$分子中$\rm N$原子上的孤电子对与$\rm B$原子的空轨道形成配位键,使得$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$分子中的$\rm N$原子上电子云密度变小,$\rm N-H$键极性变大,容易电离出氢离子,$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$酸性强于$\text{N}{{\text{H}}_{3}}$;$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$酸性强于$\rm NH_{3}$,一定条件下等物质的量$\text{Na}$与$\text{N}{{\text{H}}_{3}}\text{B}{{\text{H}}_{3}}$反应生成$\rm BH_{3}NH_{2}Na$和$\rm H_{2}$,反应的化学方程式为$\text{2Na+2N}\text{H}_{\text{3}}\text{B}\text{H}_{3}\begin{matrix}\underline{\underline{一定条件 }}\\\\\end{matrix}\text{2B}\text{H}_{3}\text{N}\text{H}_{\text{2}}\text{Na+}\text{H}_{\text{2}}\uparrow$
该化合物的化学式为 。
$\\text{R}{{\\text{e}}_{\\text{2}}}\\text{Cu}{{\\text{O}}_{\\text{4}}}$
"]]根据晶胞图可知$\rm 1$个晶胞中$\rm Re$棱上$\rm 8$个、体内$\rm 2$个;$\rm Cu$顶点$\rm 8$个、体内$\rm 1$个;$\rm O$棱上$\rm 16$个,体内$\rm 2$,面上$\rm 4$个,含有$\rm Re$:$8\times \dfrac{1}{4}+2=4$,$\rm Cu$:$8\times \dfrac{1}{8}+1=2$,$\rm O$:$16\times \dfrac{1}{4}+4\times \dfrac{1}{2}+2=8$,原子个数比$\rm Re:Cu:O=4:2:8=2:1:4$,化合物的化学式为$\text{R}{{\text{e}}_{\text{2}}}\text{Cu}{{\text{O}}_{\text{4}}}$
$\rm Cu$的配位数为 。
$\\rm 6$
"]]$\rm Cu$的配位数即与铜离子距离最近的阴离子氧离子个数,根据晶胞结构可知顶点处的铜与所在棱心上的氧可知铜的配位数为$\rm 6$
高中 | 杂化轨道理论题目答案及解析(完整版)
