高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
非金属卤化物中心原子具有${{\delta }^{+}}$和价层空轨道时可发生亲核水解;中心原子有孤电子对时,孤电子对进攻${{\text{H}}_{2}}\text{O}$的${{\text{H}}^{+}}$可发生亲电水解。$\text{SiC}{{\text{l}}_{4}}$亲核水解机理如图。下列说法错误的是$(\qquad)$
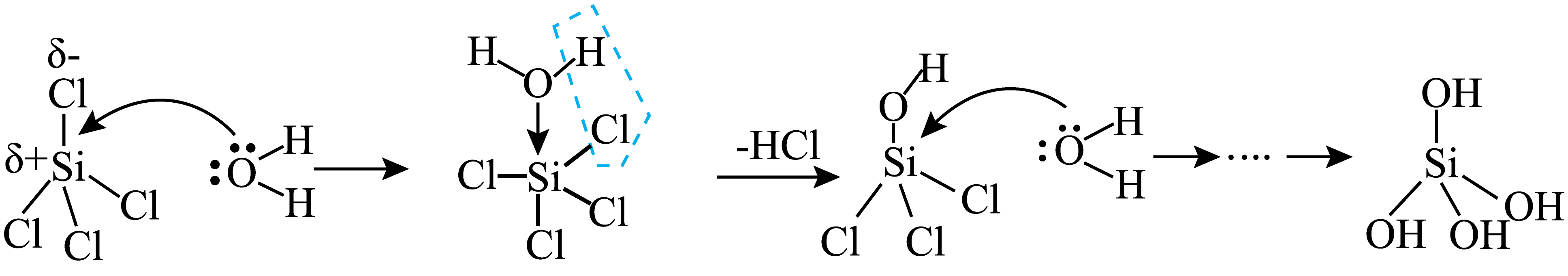
图示过程只有极性键的断裂与生成
","图示过程中$\\text{Si}$有$\\rm 2$种杂化方式
","$\\text{CC}{{\\text{l}}_{4}}$和${\\mathrm{PCl}_{3}}$均能发生亲核水解
","$\\text{NC}{{\\text{l}}_{3}}$水解产物可能为$\\text{N}{{\\text{H}}_{3}}$和$\\text{HClO}$
"]$\rm A$.图示中有$\rm H-O$、$\rm Si-Cl$极性键断开,有$\rm Si-O$、$\rm H-Cl$极性键生成,$\rm A$正确;
$\rm B$.$\rm SiCl_{4}$的$\rm Si$杂化方式为$\rm sp^{3}$,与水分子中的$\rm O$原子成键后,周围有$\rm 5$个共价键,杂化方式为$\rm sp^{3}d$,$\rm B$正确;
$\rm C$.$\rm C$的最外层为$\rm L$层,没有$\rm d$轨道接受水中的孤电子对,${\mathrm{PCl}_{3}}$的中心原子$\rm P$上有孤电子对,发生亲电水解,二者均不能发生亲核水解,$\rm C$错误;
$\rm D$.$\text{NC}{{\text{l}}_{3}}$中心原子$\rm N$上有孤电子对,孤电子对进攻${{\text{H}}_{2}}\text{O}$的${{\text{H}}^{+}}$可发生亲电水解,得到$\rm NH_{3}$和$\rm HClO$,$\rm D$正确;
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
