高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
短周期同主族元素$\text{X}$和$\text{Y}$可形成常见化合物$\text{M}$。固态$\text{M}$中主要存在环状${{\text{M}}_{3}}$和链状$\text{M}_{n}$,结构如图。$\rm Y$原子最外层电子数是其内层的$\rm 3$倍。下列说法正确的是$(\qquad)$
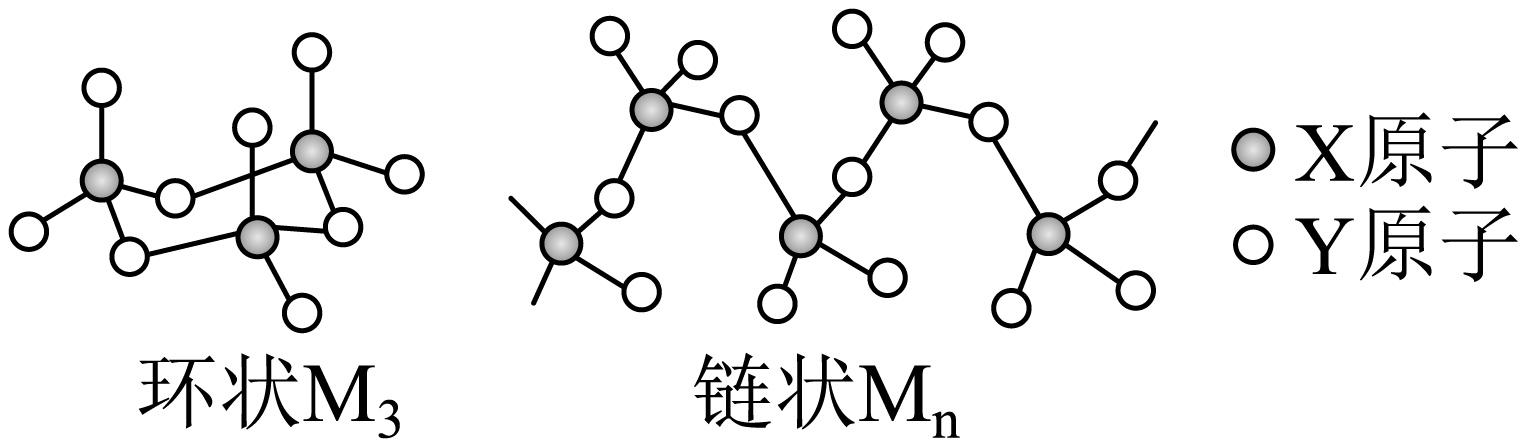
$\\text{M}$中$\\text{X}$和$\\text{Y}$的原子个数比为$1:2$
","简单氢化物的沸点:$\\text{X}\\gt \\text{Y}$
","固态环状${{\\text{M}}_{3}}$为分子晶体、链状$\\rm M_\\textit{n}$为共价晶体
","链状$\\rm M_\\textit{n}$中$\\text{s}{{\\text{p}}^{3}}$杂化的$\\text{Y}$原子个数为$\\textit{n}-1$
"]$\rm Y$原子最外层电子数是其内层的$\rm 3$倍,则$\rm Y$为$\rm O$;$\text{X}$和$\text{Y}$为短周期同主族元素,故$\rm X$为$\rm S$。
$\rm A$.根据环状$\rm M_{3}$和链状$\rm M_\textit{n}$的结构可知,$\rm S$和$\rm O$形成的常见化合物$\rm M$为$\rm SO_{3}$,原子个数比不是$1:2$,$\rm A$错误;
$\rm B$.水分子间存在氢键,使其沸点远高于硫化氢,$\rm B$错误;
$\rm C$.固态环状$\rm M_{3}$和链状$\rm M_\textit{n}$,都是三氧化硫的不同形态,三氧化硫是由分子构成的,属于分子晶体,$\rm C$错误;
$\rm D$.在链状$\rm M_\textit{x}$即$\rm (SO_{3})_\textit{n}$中,每个$\rm O$原子与$\rm S$原子形成共价键,其中,链上的氧为$\rm sp^{3}$杂化,而链端的氧不杂化,因此,链状$\rm M_\textit{n}$中$\text{s}{{\text{p}}^{3}}$杂化的$\text{Y}$原子个数为$\textit{n}-1$,$\rm D$正确;
故选:$\rm D$
高中 | 杂化轨道理论题目答案及解析(完整版)
