高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
硫锂电池具有高能量密度且价格低廉。一种添加有机电解质的新型硫锂电池,添加剂$\rm 4-$巯基吡啶$\rm (4MPy)$可先在体系中转化为吡啶硫醇锂$\rm (Li-PyS)$,其后放电过程的工作原理如图所示。设${{N}_{\text{A}}}$为阿伏加德罗常数的值。下列叙述正确的是$(\qquad)$
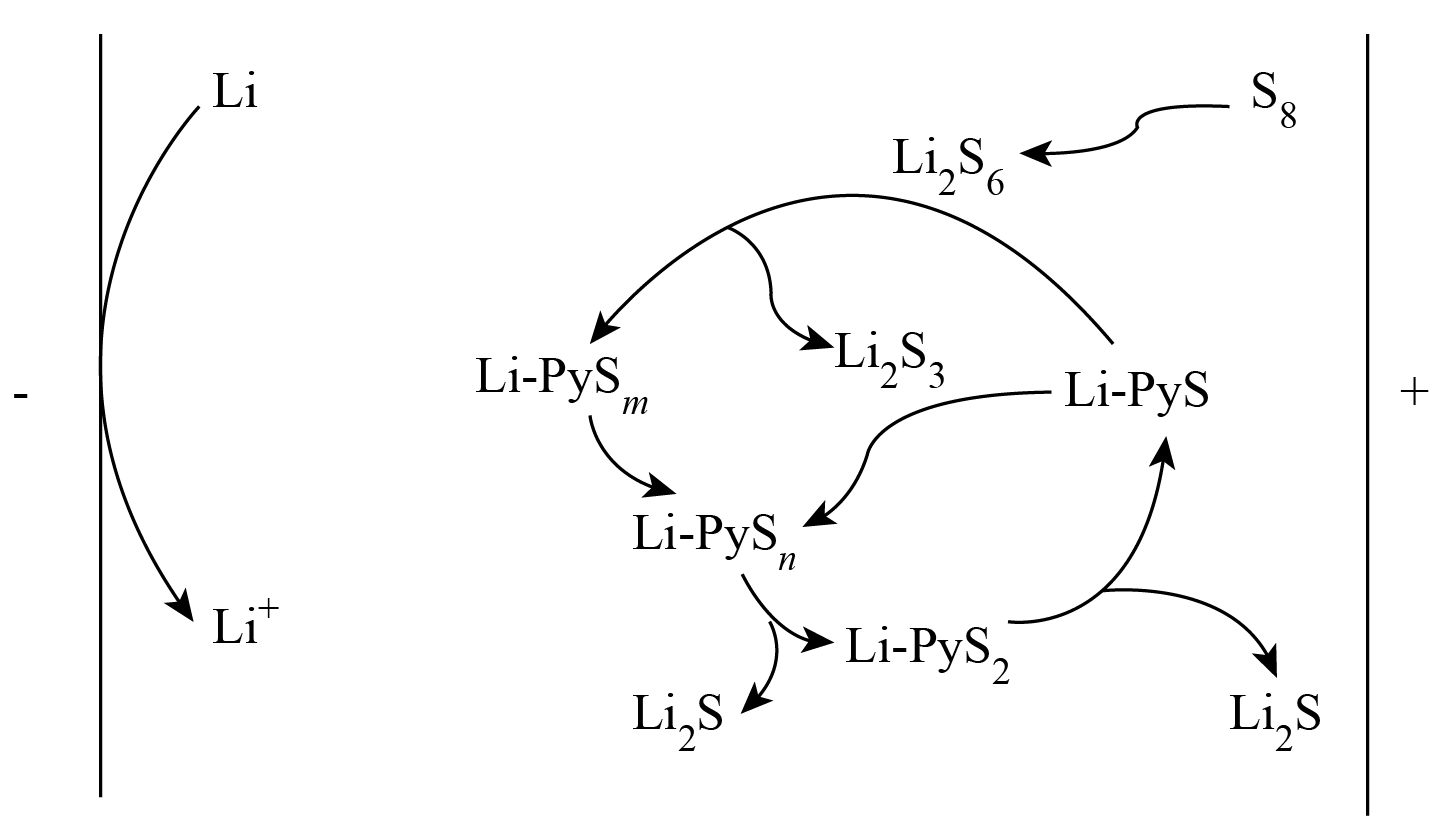
放电过程中的催化剂为$\\rm 4MPy$
","若$\\rm Li-PyS$与$\\text{L}{{\\text{i}}_{2}}{{\\text{S}}_{6}}$反应的物质的量之比为$\\rm 1: 1$,则$\\text{Li}-\\text{Py}{{\\text{S}}_{m}}$中的$m$为$\\rm 5$
","$\\rm 1\\;\\rm mol$ $\\text{Li}-\\text{Py}{{\\text{S}}_{n}}$完全转化为$\\text{Li}-\\text{Py}{{\\text{S}}_{2}}$,理论上得到电子数目为$\\left( 2n-4 \\right){{N}_{\\text{A}}}$
","正极总的电极反应式可表示为${\\mathrm{S}_{8}-16 \\mathrm{e}^{-}+16 \\mathrm{Li}^{+}=8 \\mathrm{Li}_{2} \\mathrm{S}}$
"]放电过程中,右侧$\rm Li-PyS$先消耗再生成,为催化剂,正极上$\rm S_{8}$最终还原为$\rm Li_{2}S$,负极上$\rm Li$氧化为$\rm Li^{+}$。
$\rm A$.放电过程中,右侧$\rm Li-PyS$先消耗再生成,为催化剂,$\rm A$错误;
$\rm B$.若$\rm Li-PyS$与$\text{L}{{\text{i}}_{2}}{{\text{S}}_{6}}$反应的物质的量之比为$\rm 1: 1$,即$\text{Li}-\text{PyS}+\text{L}{{\text{i}}_{2}}{{\text{S}}_{6}}=\text{L}{{\text{i}}_{2}}{{\text{S}}_{3}}+\text{Li}-\text{Py}{{\text{S}}_{4}}$,$m$为$\rm 4$,$\rm B$错误;
$\rm C$. $\text{Li}-\text{Py}{{\text{S}}_{n}}$转化为$\text{Li}-\text{Py}{{\text{S}}_{2}}$:$\text{Li}-\text{Py}{{\text{S}}_{n}}+\left( 2n-4 \right){{\text{e}}^{-}}=\text{Li}-\text{Py}{{\text{S}}_{2}}+\left( n-2 \right){{\text{S}}^{2-}}$,则$\rm 1\;\rm mol$ $\text{Li}-\text{Py}{{\text{S}}_{n}}$完全转化为$\text{Li}-\text{Py}{{\text{S}}_{2}}$,理论上得到电子数目为$\left( 2n-4 \right){{N}_{\text{A}}}$,$\rm C$正确;
$\rm D$.正极发生得电子的还原反应,正极总的电极反应式可表示为${{\text{S}}_{8}}+16{{\text{e}}^{-}}+16\text{L}{{\text{i}}^{+}}=8\text{L}{{\text{i}}_{2}}\text{S}$,$\rm D$错误。
故选:$\rm C$
高中 | 原电池工作原理题目答案及解析(完整版)
