高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
某乙烯燃料电池的工作原理如图所示。下列说法正确的是$(\quad\ \ \ \ )$
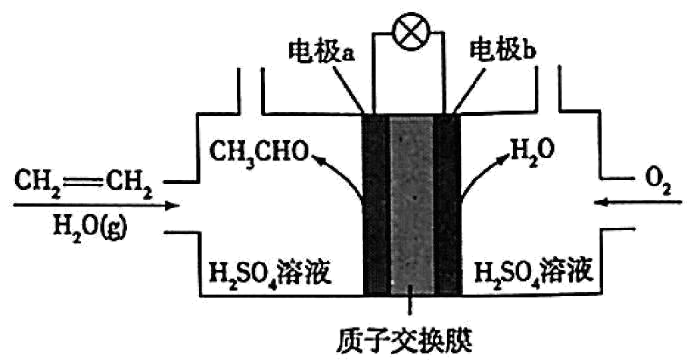
电池工作时,电流从电极$\\text{a}$经导线流向电极$\\text{b}$
","电极$\\text{b}$的电极反应式为${{\\text{O}}_{2}}-4{{\\text{e}}^{-}}+4{{\\text{H}}^{+}}=2{{\\text{H}}_{2}}\\text{O}$
","当电极$\\text{a}$消耗标准状况下$1.12\\text{ L C}{{\\text{H}}_{2}}=\\text{C}{{\\text{H}}_{2}}$时,有$0.1\\ \\text{mol }{{\\text{H}}^{+}}$通过质子交换膜
","验证生成$\\text{C}{{\\text{H}}_{3}}\\text{CHO}$的操作:取反应后的左室溶液于试管中,向其中加入新制$\\text{Cu}{{\\left( \\text{OH} \\right)}_{2}}$,加热,观察现象
"]$\rm A$.在燃料电池中,通入燃料的电极$\text{a}$为负极,通入氧气的电极$\text{b}$为正极,电流由正极$\text{b}$经导线流向负极$\text{a}$,$\rm A$选项错误;
$\rm B$.电极$\text{b}$为正极,氧气在正极得电子发生还原反应,其电极反应式应为${{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{+4}{{\text{H}}^{+}}\text{=2}{{\text{H}}_{\text{2}}}\text{O}$,$\rm B$选项错误;
$\rm C$.标准状况下$\rm 1.12$ $\rm L$ $\text{C}{{\text{H}}_{2}}\text{=C}{{\text{H}}_{2}}$的物质的量为$n=\dfrac{\text{1}\text{.12 L}}{\text{22}\text{.4 L/mol}}\text{=0}\text{.05 mol}$,根据电极$\rm a$的反应$\text{C}{{\text{H}}_{\text{2}}}\text{=C}{{\text{H}}_{\text{2}}}\text{-2}{{\text{e}}^{-}}+{{\text{H}}_{\text{2}}}\text{O=C}{{\text{H}}_{\text{3}}}\text{CHO+2}{{\text{H}}^{+}}$,$\rm 1$ $\rm mol$乙烯反应转移$\rm 2\;\rm mol$电子,同时生成$\rm 2\;\rm mol\ {{\text{H}}^{+}}$,那么$\rm 0.05$ $\rm mol$乙烯反应转移$\rm 0.1$ $\rm mol$电子,会有$\rm 0.1\;\rm mol\ {{\text{H}}^{+}}$通过质子交换膜,$\rm C$选项正确;
$\rm D$.反应后的左室溶液中可能含有未反应完的${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,应先加$\text{NaOH}$溶液中和硫酸至碱性,再加入新制$\text{Cu}{{\left( \text{OH} \right)}_{2}}$加热,否则硫酸会与$\text{Cu}{{\left( \text{OH} \right)}_{2}}$反应影响乙醛检验,$\rm D$选项错误;
故选:$\rm C$
高中 | 原电池工作原理题目答案及解析(完整版)
