高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
水是化学反应的良好介质,探索水溶液中的酸碱平衡具有重要意义。
天然水中可以分离出重水$\rm (D_{2}O)$。$\rm D_{2}O$溶液中存在电离平衡:${{\text{D}}_{2}}\text{O}\rightleftharpoons {{\text{D}}^{+}}+\text{O}{{\text{D}}^{-}}$,$c\rm (D^{+})$和$c(\rm OD^{-})$的关系如图所示。

①图中$\rm 3$个状态点对应的溶液呈中性的是 。
②${{ {T}}_{1}}$ ${{ {T}}_{2}}\rm ($填“$\rm \gt $”“$\rm =$”或者“$\rm \lt $”$\rm )$。
$\\rm B$;$\\rm \\gt $
"]]①重水中存在电离平衡$\rm {{{D}}_{2}}{O}\rightleftharpoons {{{D}}^{-}}+{O}{{{D}}^{-}}$,中性溶液中,${c(}{{{\rm D}}^{-}})={c}\rm ({O}{{{D}}^{-}})$,只有$\rm B$点符合,所以“$\rm A$、$\rm B$、$\rm C$”三点中呈中性的是$\rm B$点;
②水的电离平衡为吸热过程,温度升高,电离程度增大,${c(}{\rm {{D}}^{-}})$,${c}(\rm {O}{{{D}}^{-}})$均增大,$ K_\rm w$也增大,由图可知,$ T_{1}$时离子浓度更高,$ K_\rm w$更大,所以${{{T}}_{1}} \gt {{{T}}_{2}}$;
用如图所示电化学装置进行如下实验。
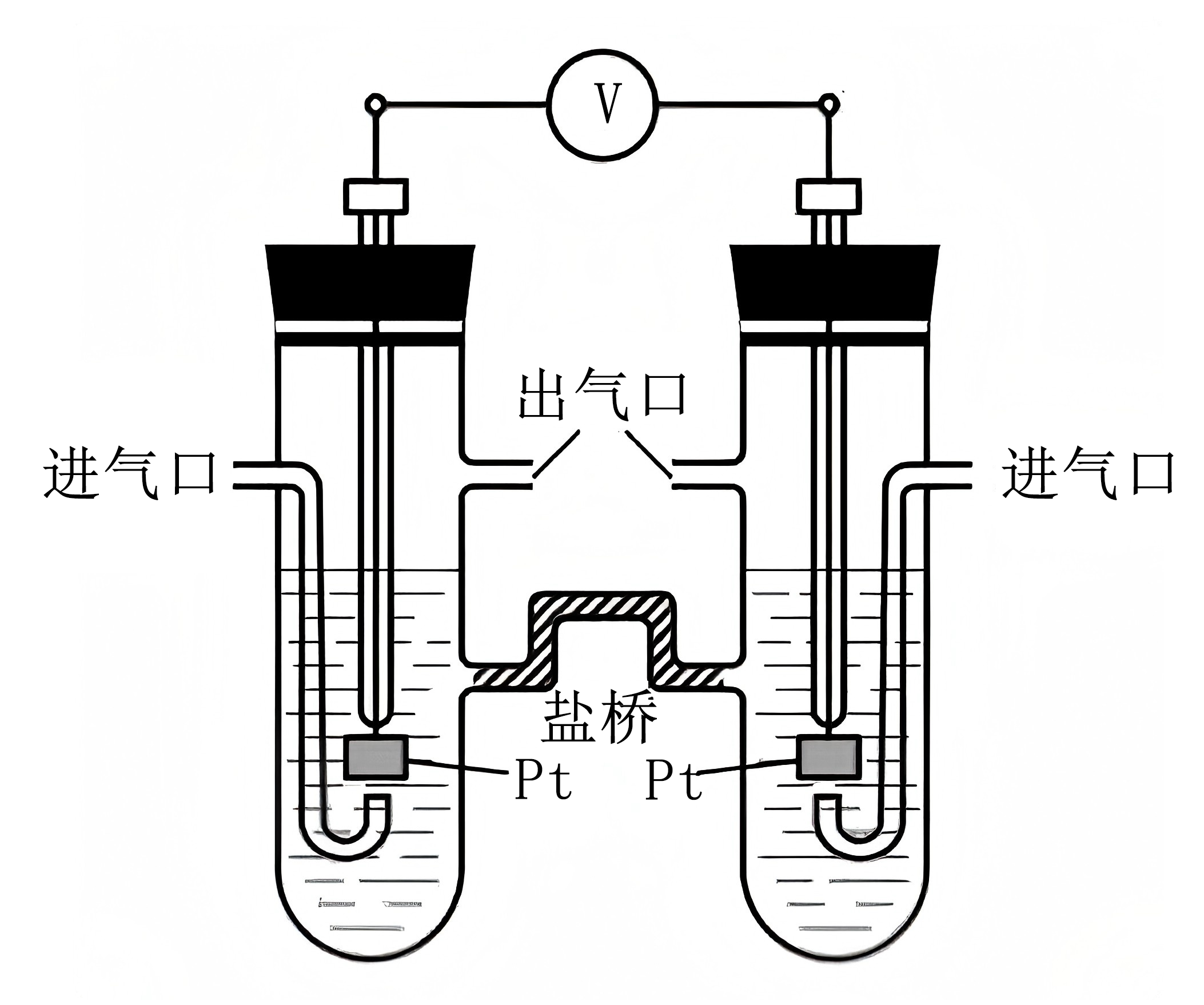
①用${{\text{H}}_{2}}$实验:在左侧通入${{\text{H}}_{2}}$,产物为${{\text{H}}_{2}}\text{O}$,盐桥中${{\text{K}}^{+}}$移向装置的 $\rm ($填“左侧”或者“右侧”$\rm )$,电池的总反应为 。
②用${{\text{O}}_{2}}$实验:在一侧通入${{\text{O}}_{2}}$,电池的总反应仍保持不变,该侧的电极反应为 。
右侧;$\\text{2}{{\\text{H}}_{\\text{2}}}+{{\\text{O}}_{\\text{2}}}=2{{\\text{H}}_{2}}\\text{O}$;${{\\text{O}}_{2}}+4{{\\text{e}}^{-}}+2{{\\text{H}}_{2}}\\text{O}=4\\text{O}{{\\text{H}}^{-}}$
"]]①用${{\text{H}}_{2}}$进行实验,左侧通入${{\text{H}}_{2}}$,产物为${{\text{H}}_{2}}\text{O}$,电极方程式为:${{\text{H}}_{\text{2}}}\text{-2}{{\text{e}}^{-}}\text{+2O}{{\text{H}}^{-}}\text{=2}{{\text{H}}_{\text{2}}}\text{O}$,左侧为负极,右侧为正极,电极方程式为${{\text{O}}_{2}}+4{{\text{e}}^{-}}+2{{\text{H}}_{2}}\text{O}=4\text{O}{{\text{H}}^{-}}$,在原电池中,正电荷向正极移动,所以盐桥中${{\text{K}}^{+}}$移向正极,即右侧,该电池为燃料电池,原料为氢气和氧气,总反应方程式为$\text{2}{{\text{H}}_{\text{2}}}+{{\text{O}}_{\text{2}}}=2{{\text{H}}_{2}}\text{O}$;
②用${{\text{O}}_{2}}$进行实验,一侧通入${{\text{O}}_{2}}$,电池总反应方程式不变,则该电池为氢气和氧气组成的燃料电池,该侧的电极反应方程式为${{\text{O}}_{2}}+4{{\text{e}}^{-}}+2{{\text{H}}_{2}}\text{O}=4\text{O}{{\text{H}}^{-}}$;
利用驰豫法可研究快速反应的速率常数$(k$,在一定温度下为常数$\rm )$。其原理是通过微扰$\rm ($如瞬时升温$\rm )$使化学平衡发生偏离,观测体系微扰后从不平衡态趋向新平衡态所需的驰豫时间$\rm ({ }\tau{ }\rm )$,从而获得$k$的信息。对于$\rm {{{H}}_{2}}{O}\rightleftharpoons {{{H}}^{+}}+{O}{{{H}}^{-}}$,若将纯水瞬时升温到$\rm 25\;\rm ^\circ\rm C$,测得${ }\tau=4.0\times {{10}^{-5}}\rm \;{s}$。已知:$\rm 25\;\rm ^\circ\rm C$时,${c}\left(\rm {{{H}}_{2}}{O} \right)=55.6\;\rm {mol}/{L}$,${v}\left(\rm正 \right)={{{k}}_{1}}{c}\left(\rm {{{H}}_{2}}{O} \right)$,${v}\left(\rm逆 \right)={{{k}}_{2}}{c}\left(\rm {{{H}}^{+}} \right){c}\left(\rm {O}{{{H}}^{-}} \right)$,$\tau{ }=\dfrac{1}{{{{k}}_{1}}+2{{{k}}_{2}}{{{x}}_{\rm {e}}}} ({{x}_{\rm {e}}}$为$\rm {{{H}}^{+}}$的平衡浓度$\rm )$。
①$\rm 25\;\rm ^\circ\rm C$时,$\rm {{{H}}_{2}}{O}\rightleftharpoons {{{H}}^{+}}+{O}{{{H}}^{-}}$的平衡常数${K}=$ $\;\rm {mol}/{L}\rm ($保留$\rm 2$位有效数字$\rm )$。
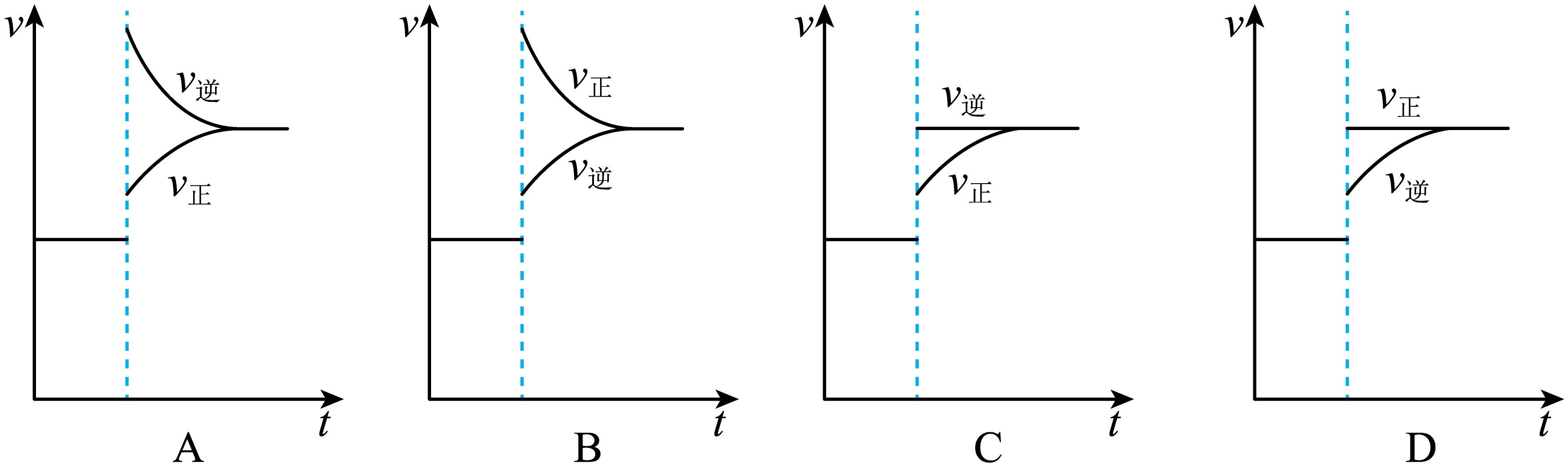
②下列能正确表示瞬时升温后反应建立新平衡的过程示意图为 。
③$\rm 25\;\rm ^\circ\rm C$时,计算得${{ {k}}_{2}}$为 $\text{L}/\left( \text{mol}\cdot \text{s} \right)$。
${K}=1.8\\times {{10}^{-16}}$;$\\rm D$;${{{k}}_{2}}=1.25\\times {{10}^{11}}$
"]]①对于反应$\rm {{{H}}_{2}}{O}\rightleftharpoons {{{H}}^{+}}+{O}{{{H}}^{-}}$,平衡常数$ K$的定义为:$ K=\dfrac{c\left(\rm {{{H}}^{+}} \right){c}\left(\rm {O}{{{H}}^{-}} \right)}{{c}\left(\rm {{{H}}_{2}}{O} \right)}$,在$\rm 25\;\rm ^\circ\rm C$的纯水中,水的离子积常数为$ K_{\rm w}={c}\left(\rm {{{H}}^{+}} \right){c}\left(\rm {O}{{{H}}^{-}} \right)=1\times {{10}^{-14}}$,而且平衡时${c}\left(\rm {{{H}}^{+}} \right){=c}\left(\rm {O}{{{H}}^{-}} \right)=1\times {{10}^{-7}}$,已知${c}\left(\rm {{{H}}_{2}}{O} \right)=55.6\;\rm {mol}/{L}$,带入公式:$ K=\dfrac{1\times {{10}^{-7}}{{}^{2}}}{55.6}=\dfrac{{{10}^{-14}}}{55.6}\approx 1.798\times {{10}^{-16}}$,保留两位小数$ K=1.8\times {{10}^{-16}}$;
②瞬时升温后,逆反应速率增大,但水的浓度是恒定的,正反应速率不变,所以建立新平衡的过程示意图为$\rm D$,
③驰豫时间公式为$\tau=\dfrac{1}{{{{k}}_{1}}+2{{{k}}_{2}}{{{x}}_{\rm {e}}}}$,其中$\tau=4.0\times {{10}^{-5}}\rm \;{s}$,${{{x}}_{\rm {e}}}{=c}\left(\rm {{{H}}^{+}} \right)=1\times {{10}^{-7}}$,带入得:${{{k}}_{1}}+2{{{k}}_{2}}\times {(1}\times {1}{{{0}}^{{-7}}}{)}=\dfrac{1}{\tau}=\dfrac{1}{4\times {1}{{{0}}^{{-5}}}}=2.5\times {1}{{{0}}^{{4}}}\rm \;{{{s}}^{{-1}}}$,在平衡时,${v}\left(\rm正 \right)={v}\left(\rm逆 \right)$,可推出${{{k}}_{1}}{c}\left(\rm {{{H}}_{2}}{O} \right)={{{k}}_{2}}{c}\left(\rm {{{H}}^{+}} \right){c}\left(\rm {O}{{{H}}^{-}} \right)={{{k}}_{2}}{x}_{\rm {e}}^{{2}}$,带入已知值:${{{k}}_{1}}\times 55.6={{{k}}_{2}}\times {{(1\times {{10}^{-7}})}^{2}}$,即${{{k}}_{1}}=\dfrac{{{{k}}_{2}}\times {{10}^{-14}}}{55.6}$,将$k_{1}$带入驰豫时间公式为:$\dfrac{{{{k}}_{2}}\times {{10}^{-14}}}{55.6}{+2}{{{k}}_{2}}\times 1\times {{10}^{-7}}=2.5\times {{10}^{4}}$,整理可得,${{{k}}_{2}}(\dfrac{{{10}^{-14}}}{55.6}{+2}\times {{10}^{-7}})=2.5\times {{10}^{4}}$,计算括号内:$\dfrac{{{10}^{-14}}}{55.6}\approx 1.80\times {{10}^{-16}}$,${2}\times {{10}^{-7}}=2.00\times {{10}^{-7}}$,由于$1.80\times {{10}^{-16}}\ll 2.00\times {{10}^{-7}}$,可忽略不计,所以${{{k}}_{2}}\times 2\times {{10}^{-7}}=2.5\times {{10}^{4}}$,得出${{{k}}_{2}}=1.25\times {{10}^{11}}\rm \;{L}/\left(\rm {mol}\cdot {s} \right)$。
高中 | 化学平衡常数题目答案及解析(完整版)
