高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
在温和条件下,将$\text{CO}$转化为${{\text{C}}_{\text{4}}}$烃类具有重要意义。采用电化学$\rm -$化学串联催化策略可将$\text{CO}$高选择性合成${{\text{C}}_{\text{4}}}{{\text{H}}_{\text{10}}}$,该流程示意图如下:
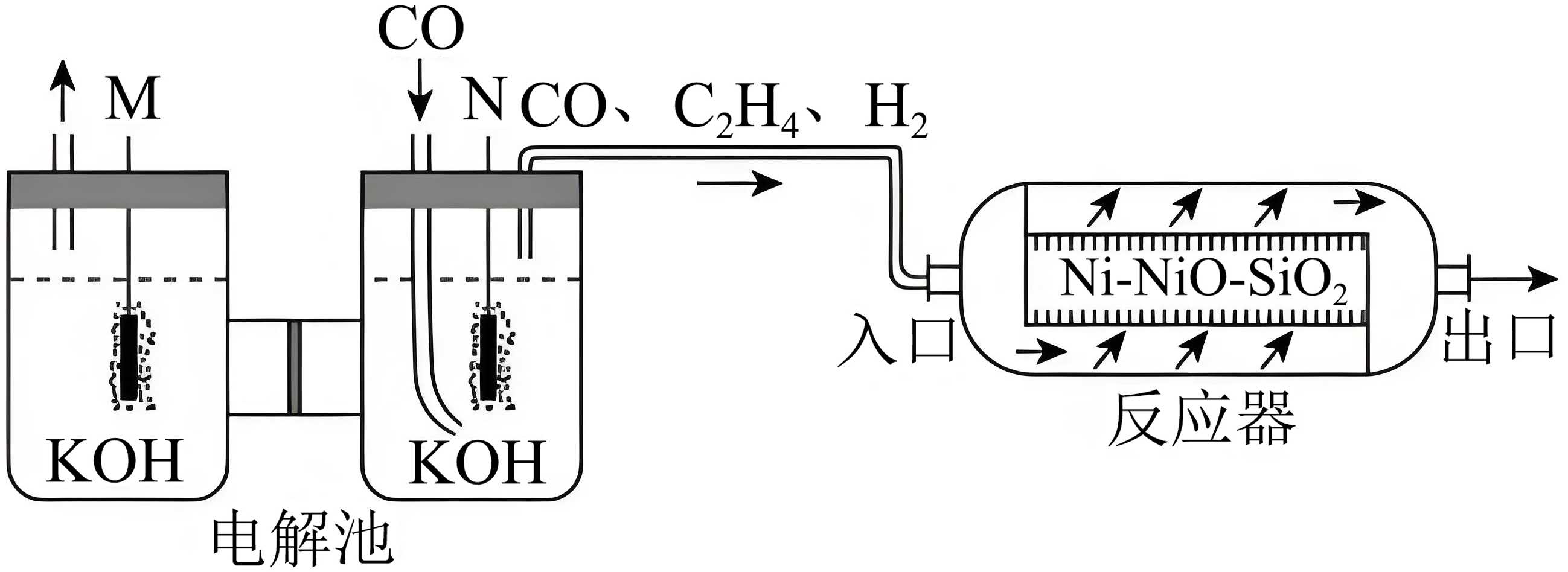
回答下列问题:
电解池中电极$\rm M$与电源的 极相连。
正
"]]由图可知,$\rm N$电极上$\rm CO$转化为$\rm C_{2}H_{4}$,$\rm C$元素化合价下降,发生还原反应,$\rm N$为阴极,则$\rm M$为阳极,与电源正极相连;
$\text{CO}$放电生成${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}$的电极反应式为 。
$\\text{2CO}+8{{\\text{e}}^{-}}+6{{\\text{H}}_{2}}\\text{O}={{\\text{C}}_{2}}{{\\text{H}}_{4}}\\text{+8O}{{\\text{H}}^{-}}$
"]]$\rm CO$发生得电子的还原反应转化为$\rm C_{2}H_{4}$,电解液是碱性环境,电极反应为:$\text{2CO}+8{{\text{e}}^{-}}+6{{\text{H}}_{2}}\text{O}={{\text{C}}_{2}}{{\text{H}}_{4}}\text{+8O}{{\text{H}}^{-}}$;
在反应器中,发生如下反应:
反应$\rm i$:$2{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})\rightleftharpoons {{\text{C}}_{4}}{{\text{H}}_{8}}(\text{g})\qquad \Delta {{ {H}}_{1}}=-104.7\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm ii$:$2{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons {{\text{C}}_{4}}{{\text{H}}_{10}}(\text{g})\qquad \Delta {{ {H}}_{2}}=-230.7\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
计算反应${{\text{C}}_{4}}{{\text{H}}_{8}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons {{\text{C}}_{4}}{{\text{H}}_{10}}(\text{g})$的$\Delta {H}=$ $ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,该反应 $\rm ($填标号$\rm )$。
$\rm A$.高温自发 $\rm B$.低温自发 $\rm C$.高温低温均自发 $\rm D$.高温低温均不自发
$\\rm -126$;$\\rm B$
"]]根据盖斯定律,反应$\rm ii-$反应$\rm i$即可得到目标反应,则${ }\Delta{ H=}-{230}{.7\;\rm kJ/mol}-\left(- 104.7\;\rm {kJ/mol} \right)=-126\;\rm {kJ/mol}$,该反应是熵减的放热反应,则依据$\Delta {G=}\Delta {H}-{T}\Delta {S}\lt 0$反应能自发进行,则低温下自发进行,选$\rm B$;
一定温度下,$\text{CO}{{\text{C}}_{2}}{{\text{H}}_{4}}$和${{\text{H}}_{2}}\rm ($体积比为$ {x}:2:1\rm )$按一定流速进入装有催化剂的恒容反应器$\rm ($入口压强为$\text{100\;\rm kPa}\rm )$发生反应$\rm i$和$\rm ii$。有$\text{CO}$存在时,反应$\rm ii$的反应进程如图$\rm 1$所示。随着$x$的增加,${{\text{C}}_{2}}{{\text{H}}_{4}}$的转化率和产物的选择性$\rm ($选择性$=\dfrac{转化为目的产物所消耗乙烯的量}{已转化的乙烯总量}\times 100\%\rm )$如图$\rm 2$所示。
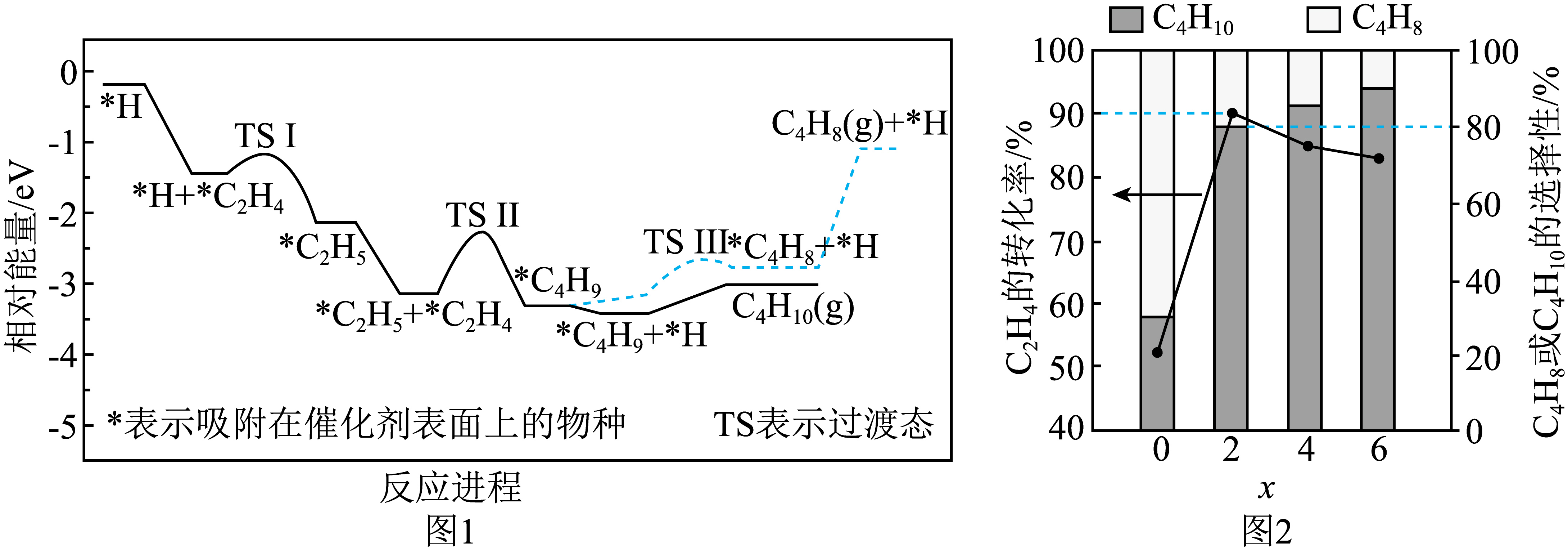
根据图$\rm 1$,写出生成${{\text{C}}_{4}}{{\text{H}}_{10}}$的决速步反应式 ;${{\text{C}}_{4}}{{\text{H}}_{10}}$的选择性大于${{\text{C}}_{4}}{{\text{H}}_{8}}$的原因是 。
②结合图$\rm 2$,当$ {x}\geqslant 2$时,混合气体以较低的流速经过恒容反应器时,反应近似达到平衡,随着$x$的增大,${{\text{C}}_{2}}{{\text{H}}_{4}}$的转化率减小的原因是 ;当$ {x}=2$时,该温度下反应$\rm ii$的${{ {K}}_{\text{p}}}=$ ${{(\text{kPa})}^{-2}}\rm ($保留两位小数$\rm )$。
$^{*}{{\\text{C}}_{2}}{{\\text{H}}_{5}}{{+}^{*}}{{\\text{C}}_{2}}{{\\text{H}}_{4}}{{=}^{*}}{{\\text{C}}_{4}}{{\\text{H}}_{9}}$;由${{\\text{C}}_{4}}{{\\text{H}}_{9}}$生成${{\\text{C}}_{4}}{{\\text{H}}_{8}}$时,活化能较大,反应速率慢;随着$x$的增大,$\\rm CO$的分压增大,对于反应$\\rm i$和反应$\\rm ii$相当于减压,反应$\\rm i$和反应$\\rm ii$平衡均逆向移动,所以${{\\text{C}}_{\\text{2}}}{{\\text{H}}_{4}}$的转化率减小;$\\rm 0.16$
"]]总反应的反应速率由慢反应决定,故决速步是反应最慢的步骤,由图可知,$\rm TS$Ⅱ的垒能最大,该步骤是决速步骤,反应式为$^{*}{{\text{C}}_{2}}{{\text{H}}_{5}}{{+}^{*}}{{\text{C}}_{2}}{{\text{H}}_{4}}{{=}^{*}}{{\text{C}}_{4}}{{\text{H}}_{9}}$;由图可知,由${{\text{C}}_{4}}{{\text{H}}_{9}}$生成${{\text{C}}_{4}}{{\text{H}}_{8}}$时,活化能较大,反应速率慢,所以${{\text{C}}_{4}}{{\text{H}}_{10}}$的选择性大于${{\text{C}}_{4}}{{\text{H}}_{8}}$;
当$x\geqslant 2$时,由题意可知,该过程近似认为是平衡状态,则增大$\rm CO$的分压,相当于减压,反应$\rm i$和反应$\rm ii$平衡均逆向移动,所以${{\text{C}}_{\text{2}}}{{\text{H}}_{4}}$的转化率减小;
当$x=2$时,$\rm {{{C}}_{{2}}}{{{H}}_{4}}$的转化率为$\rm 90\%$,$\rm {{{C}}_{4}}{{{H}}_{10}}$的选择性为$\rm 80\%$,设初始投料:$\rm CO$:$\rm 2\;\rm mol$、$\rm C_{2}H_{4}$:$\rm 2\;\rm mol$、$\rm H_{2}$:$\rm 1\;\rm mol$,则${n}\left(\rm {{{C}}_{4}}{{{H}}_{10}} \right)=2\;\rm mol\times 90\%\times \dfrac{1}{2}\times 80\%=0.72\;\rm mol$、${n}\left(\rm {{{C}}_{4}}{{{H}}_{8}} \right)=2\;\rm mol\times 90\%\times \dfrac{1}{2}\times 20\%=0.18\;\rm mol$、${n}\left(\rm {{{C}}_{2}}{{{H}}_{4}} \right)=2\;\rm {mol}-2\;\rm mol\times 90\%=0.2\;\rm mol$、${n}\left(\rm {{{H}}_{2}} \right)=1\;\rm {mol}-0.72=0.28\;\rm mol$,气体总物质的量为$\rm (2+0.72+0.18+0.2+0.28)\;mol=3.38\;\rm mol$,此时压强为$\dfrac{3.38}{5}\times 100\;\rm {k}Pa=67.6\;{k}Pa$,${p}\left(\rm {{{C}}_{4}}{{{H}}_{10}} \right)=\dfrac{0.72}{3.38}\times 67.6\;\rm kPa=14.4\;\rm kPa$、${p}\left(\rm {{{C}}_{2}}{{{H}}_{4}} \right)=\dfrac{0.2}{3.38}\times 67.6\;\rm kPa=4\;\rm kPa$、${p}\left(\rm {{{H}}_{2}} \right)=\dfrac{0.28}{3.38}\times 67.6\;\rm kPa=5.6\;\rm kPa$,反应$\rm ii$的$ K_{\rm p}=\dfrac{14.4}{5.6\times {{4}^{2}}}\;{{\left(\rm {k}Pa \right)}^{-2}}\approx 0.16\;{{\left(\rm {k}Pa \right)}^{-2}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
