高中 | 氧化还原反应的计算 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应的计算题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的计算
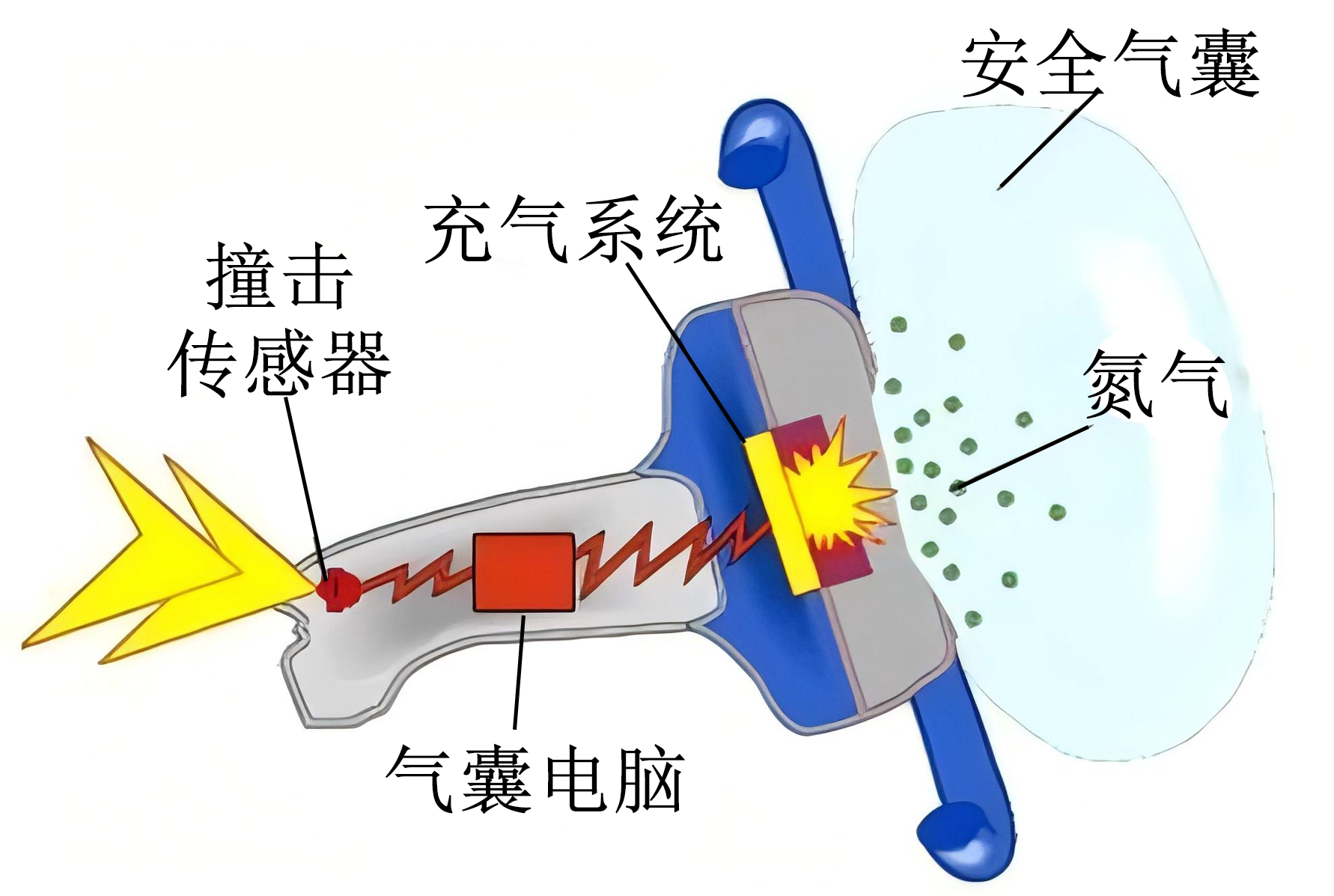
汽车的安全气囊的主要成分为$\text{Na}{{\text{N}}_{3}}$,汽车受到撞击$\text{Na}{{\text{N}}_{3}}$迅速分解得到钠和氮气,保护乘客,具体结构如图。设${{N}_{\text{A}}}$为阿伏加德罗常数,下列说法不正确的是$(\quad\ \ \ \ )$
$\\rm 4.6$ $\\rm g$ $\\rm Na$在空气中微热充分反应,生成$\\text{N}{{\\text{a}}_{2}}\\text{O}$和$\\text{N}{{\\text{a}}_{2}}{{\\text{O}}_{2}}$,转移电子数为$0.2{{N}_{\\text{A}}}$
","撞击时$4\\text{ mol Na}{{\\text{N}}_{3}}$分解,生成的氧化产物为$6{{N}_{\\text{A}}}$
","标准状况下,$11.2\\text{ L }{{\\text{N}}_{2}}$中$\\pi$键的数目为${{N}_{\\text{A}}}$
","$1\\text{ mol }{{\\text{N}}_{2}}$和$3\\text{ mol }{{\\text{O}}_{2}}$在高温下充分反应,生成的产物中原子总数为$8{{N}_{\\text{A}}}$
"]$\rm A$.钠生成$\text{N}{{\text{a}}_{2}}\text{O}$和$\text{N}{{\text{a}}_{2}}{{\text{O}}_{2}}$,都是由$\rm 0$价变为$+1$价,即$\rm 4.6\;\rm g$钠参与反应,转移电子数为$0.2{{N}_{\text{A}}}$,$\rm A$正确;
$\rm B$.撞击时发生反应的方程式为$2{{\text{N}}_{\text{a}}}{{\text{N}}_{3}}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}2\text{Na}+3{{\text{N}}_{2}}\uparrow $,氧化产物为${{\text{N}}_{2}}$,根据方程式$4\text{ mol Na}{{\text{N}}_{3}}$分解,生成的氧化产物为$6{{N}_{\text{A}}}$,$\rm B$正确;
$\rm C$.标准状况下,$11.2\text{ L }{{\text{N}}_{2}}$的物质的量为$\rm 0.5$ $\rm mol$,$\pi$键的数目为${{N}_{\text{A}}}$,$\rm C$正确;
$\rm D$.${{\text{N}}_{2}}$和${{\text{O}}_{2}}$在高温下充分反应生成$\rm NO$,氧气过量,$\rm NO$与氧气生成$\text{N}{{\text{O}}_{2}}$,$\text{N}{{\text{O}}_{2}}$部分转化成${{\text{N}}_{2}}{{\text{O}}_{4}}$,发生的反应为${{\text{N}}_{2}}+{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\\end{matrix}2\text{NO}$、$2\text{NO}+{{\text{O}}_{2}}=2\text{N}{{\text{O}}_{2}}$、$2\text{N}{{\text{O}}_{2}}\rightleftharpoons {{\text{N}}_{2}}{{\text{O}}_{4}}$。则$1\text{ mol }{{\text{N}}_{2}}$和$1\text{ mol }{{\text{O}}_{2}}$生成$2\text{ mol NO}$,$2\text{ mol NO}$与$1\text{ mol }{{\text{O}}_{2}}$反应生成$2\text{ mol N}{{\text{O}}_{2}}$,剩余$1\text{ mol }{{\text{O}}_{2}}$,则常温生成的产物中原子总数为$8{{N}_{\text{A}}}-2{{N}_{\text{A}}}=6{{N}_{\text{A}}}$,$\rm D$错误;
故选:$\rm D$
高中 | 氧化还原反应的计算题目答案及解析(完整版)
