高中 | 萃取与分液 题目答案及解析
稿件来源:高途
高中 | 萃取与分液题目答案及解析如下,仅供参考!
必修一
第一章 从实验学化学
第一节 化学实验基本方法
萃取与分液
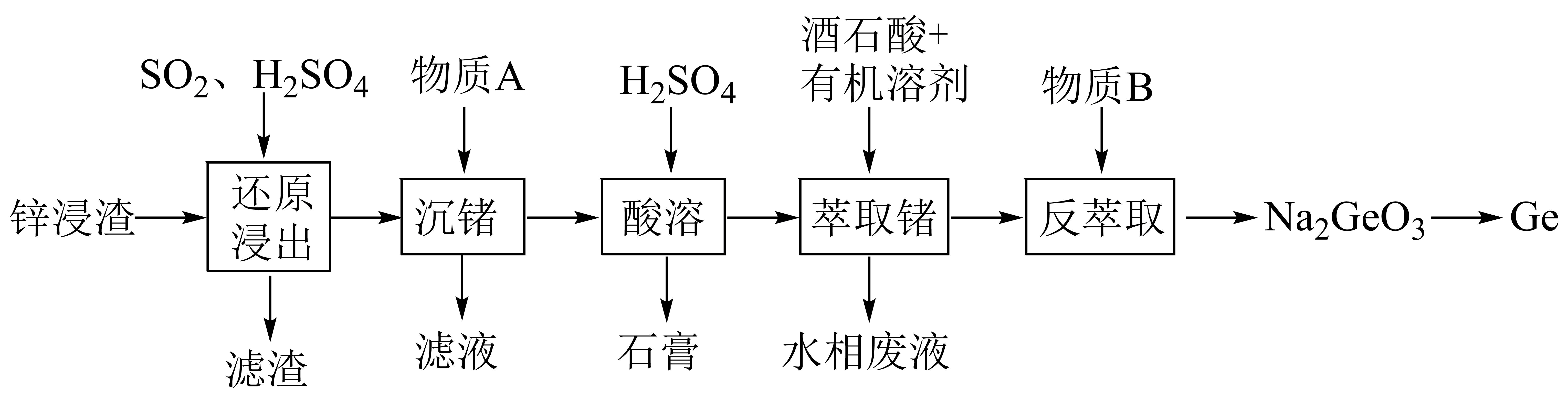
锗是一种重要的稀散金属,主要用于电子工业、光导纤维等领域。某锌浸渣中含有$\text{ZnO}$、$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\mathrm{GeO}_2$、$\text{Si}{{\text{O}}_{2}}$、$\text{PbS}{{\text{O}}_{4}}$等,利用锌浸渣提取$\text{Ge}$的实验流程如下图所示:
已知:①部分含锗微粒的存在形式与$\rm pH$的关系为:
| $\rm pH$ | $\text{pH}\lt 2$ | $\text{pH}=2.5\sim 5$ | $\text{pH}\gt 12$ |
| $\text{Ge}$存在形式 | $\text{G}{{\text{e}}^{4+}}$ | ${{\left[ \text{Ge}{{\left( \text{OH} \right)}_{3}} \right]}^{+}}$ | $\rm GeO_{\text{3}}^{\text{2}-}$ |
②部分金属离子的沉淀$\text{pH}$:
| $\text{F}{{\text{e}}^{2+}}$ | $\text{F}{{\text{e}}^{3+}}$ | $\text{Z}{{\text{n}}^{2+}}$ | |
| 开始沉淀 | $\rm 7.5$ | $\rm 2.3$ | $\rm 6.2$ |
| 沉淀完全 | $\rm 9.0$ | $\rm 3.2$ | $\rm 8.0$ |
回答下列问题:
基态锗原子中电子排布能量最高的能级为 ,“滤渣”的主要成分的化学式是 。
$\\rm 4p$;$\\text{Si}{{\\text{O}}_{2}}$、$\\text{PbS}{{\\text{O}}_{4}}$
"]]锗原子电子排布式为$\left[ \text{Ar} \right]\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{2}}}\text{4}{{\text{p}}^{\text{2}}}$,则最高能级为$\rm 4p$;由分析可知,“滤渣”的主要成分是$\text{PbS}{{\text{O}}_{\text{4}}}$、$\text{Si}{{\text{O}}_{2}}$;
$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$在“还原浸出”步骤中发生反应的离子方程式为 ,物质$\rm A$属于碱性氧化物,其化学式是 。
$\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}+2{{\\text{H}}^{+}}+\\text{S}{{\\text{O}}_{2}}=2\\text{F}{{\\text{e}}^{2+}}+\\text{SO}_{4}^{2-}+{{\\text{H}}_{2}}\\text{O}$;$\\rm CaO$
"]]还原浸出步骤中$\rm Fe_{2}O_{3}$与硫酸反应生成$\text{F}{{\text{e}}^{\text{3}}}^{+}$,然后被$\text{S}{{\text{O}}_{2}}$还原,离子方程式为:$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}+2{{\text{H}}^{+}}+\text{S}{{\text{O}}_{2}}=2\text{F}{{\text{e}}^{2+}}+\text{SO}_{4}^{2-}+{{\text{H}}_{2}}\text{O}$;由分析可知,物质$\rm A$属于碱性氧化物,酸溶后得到石膏$\left( \text{CaS}{{\text{O}}_{\text{4}}}\cdot \text{2}{{\text{H}}_{2}}\text{O} \right)$,说明物质$\rm A$中含有钙元素,则物质$\rm A$为$\text{CaO}$;
“沉锗”操作后,$\rm Ge$以$\mathrm{GeO}_2$的形式存在,随着$\rm pH$的升高,$\rm Ge$的沉淀率升高。“沉锗”操作理论上需控制$\rm pH$范围为 。
$5\\lt \\text{pH}\\lt 6.2$
"]]“沉锗”操作后,$\rm Ge$以$\rm \mathrm{GeO}_2$的形式存在,随着$\rm pH$的升高,$\rm Ge$的沉淀率升高。当 $\rm pH\lt 2$ 时,$\rm G{{e}^{4+}}$离子溶解度高,无法沉淀;当 $\rm pH$ 逐渐升高至 $\rm 2.5\sim5$,$\rm G{{e}^{4+}}$ 发生水解,生成 $\rm {{\left[ {Ge}{{\left( {OH} \right)}_{{3}}} \right]}^{+}}$,当 $\rm pH$ 进一步升高时,$\rm {pH\gt 6}{.2}$形成沉淀$\rm {Ge}{{{O}}_{{2}}}$;当 $\rm pH \gt 12$, $\rm \mathrm{GeO}_2$会与 $\rm OH^-$发生反应形成可溶性 $\rm {GeO}_{{3}}^{{2-}}$;当$\rm {pH\gt 6}{.2}$时$\rm {Z}{{{n}}^{{2}}}^{+}$可能会与 $\rm Ge$ 沉淀共存,则“沉锗”操作理论上需控制$\rm pH$范围为$\rm {5\lt pH\lt 6}{.2}$;
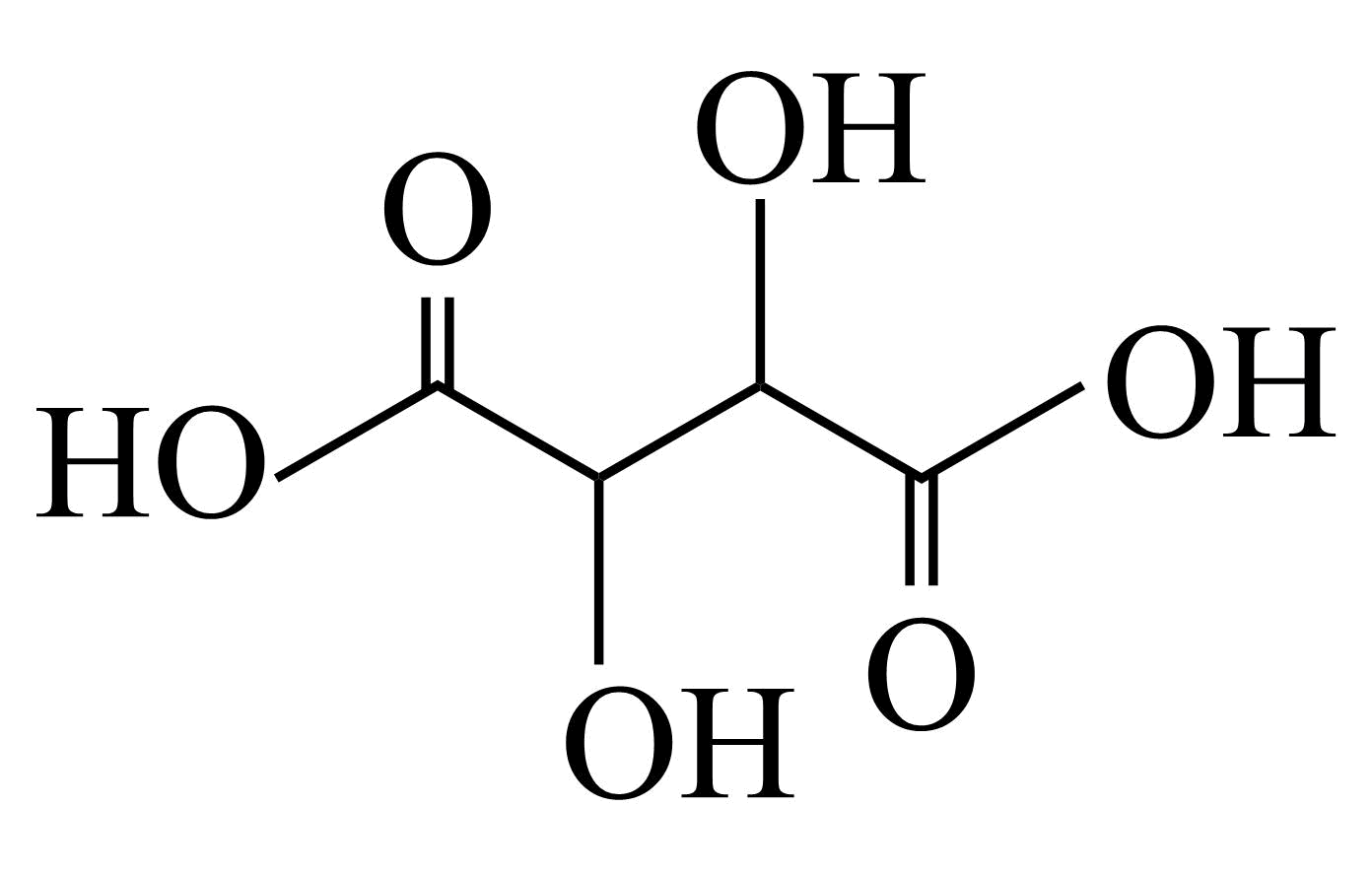
“酸溶”后,溶液的$\rm pH$为$\rm 1.8$,向溶液中加入酒石酸萃取剂,其原理为酒石酸$\rm ({{\text{C}}_{4}}{{\text{H}}_{6}}{{\text{O}}_{6}}$,结构如图所示$\rm )$与含锗微粒形成酒石酸络阴离子${{\left[ \text{Ge}{{\left( {{\text{C}}_{4}}{{\text{H}}_{4}}{{\text{O}}_{6}} \right)}_{3}} \right]}^{2-}}$。
①“萃取锗”中主要反应的离子方程式为 。
②若$\text{pH}$升高,锗的萃取率下降,原因是 。
③“反萃取”中加入的物质$\rm B$是 $\rm ($填标号$\rm )$。
$\rm a$.$\rm \text{NaOH}$溶液 $\rm b$.$\rm {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液 $\rm c$.$\rm \text{NaHS}{{\text{O}}_{4}}$溶液
$\\rm \\text{G}{{\\text{e}}^{4+}}+3{{\\text{C}}_{4}}{{\\text{H}}_{6}}{{\\text{O}}_{6}}\\rightleftharpoons {{\\left[ \\text{Ge}{{\\left( {{\\text{C}}_{4}}{{\\text{H}}_{4}}{{\\text{O}}_{6}} \\right)}_{3}} \\right]}^{2-}}+6{{\\text{H}}^{+}}$;生成$\\rm {{\\left[ \\text{Ge}{{\\left( \\text{OH} \\right)}_{3}} \\right]}^{+}}$后难以与酒石酸形成配合物;$\\rm a$
"]]①“酸溶”后,溶液的$\rm pH$为$\rm 1.8$,$\rm \text{Ge}$存在形式为$\rm G{{e}^{4+}}$,则“萃取锗”中主要反应的离子方程式为:$\rm \text{G}{{\text{e}}^{4+}}+3{{\text{C}}_{4}}{{\text{H}}_{6}}{{\text{O}}_{6}}\rightleftharpoons {{\left[ \text{Ge}{{\left( {{\text{C}}_{4}}{{\text{H}}_{4}}{{\text{O}}_{6}} \right)}_{3}} \right]}^{2-}}+6{{\text{H}}^{+}}$;
②若$\rm \text{pH}$升高,$\rm \text{Ge}$存在形式为$\rm {{\left[ \text{Ge}{{\left( \text{OH} \right)}_{\text{3}}} \right]}^{+}}$,$\rm {{\left[ \text{Ge}{{\left( \text{OH} \right)}_{\text{3}}} \right]}^{+}}$难以与酒石酸形成酒石酸络阴离子,导致锗的萃取率下降;
③反萃取后得到$\rm \text{N}{{\text{a}}_{\text{2}}}\text{Ge}{{\text{O}}_{\text{3}}}$,$\rm \text{Ge}$存在形式为$\rm \text{GeO}_{\text{3}}^{\text{2-}}$,说明此时溶液$\rm pH\gt 12 $,则物质$\rm B$为氢氧化钠溶液。
高中 | 萃取与分液题目答案及解析(完整版)
