高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
近年来全球电动汽车销量激增,废旧锂电池的回收愈发迫在眉睫。以废旧三元锂电池正极材料的硫酸浸出液(含$\rm Ni$、$\rm Co$、$\rm Mn$、$\rm Li$)为研究对象,采用$\rm Cyanex\;\rm 301$(一种酸性萃取剂)选择性分离回收其中的$\text{Ni}$和$\text{Co}$;${{E}_{\text{Co}}}$和${{E}_{\text{Ni}}}$代表萃取率。工艺流程如图所示:
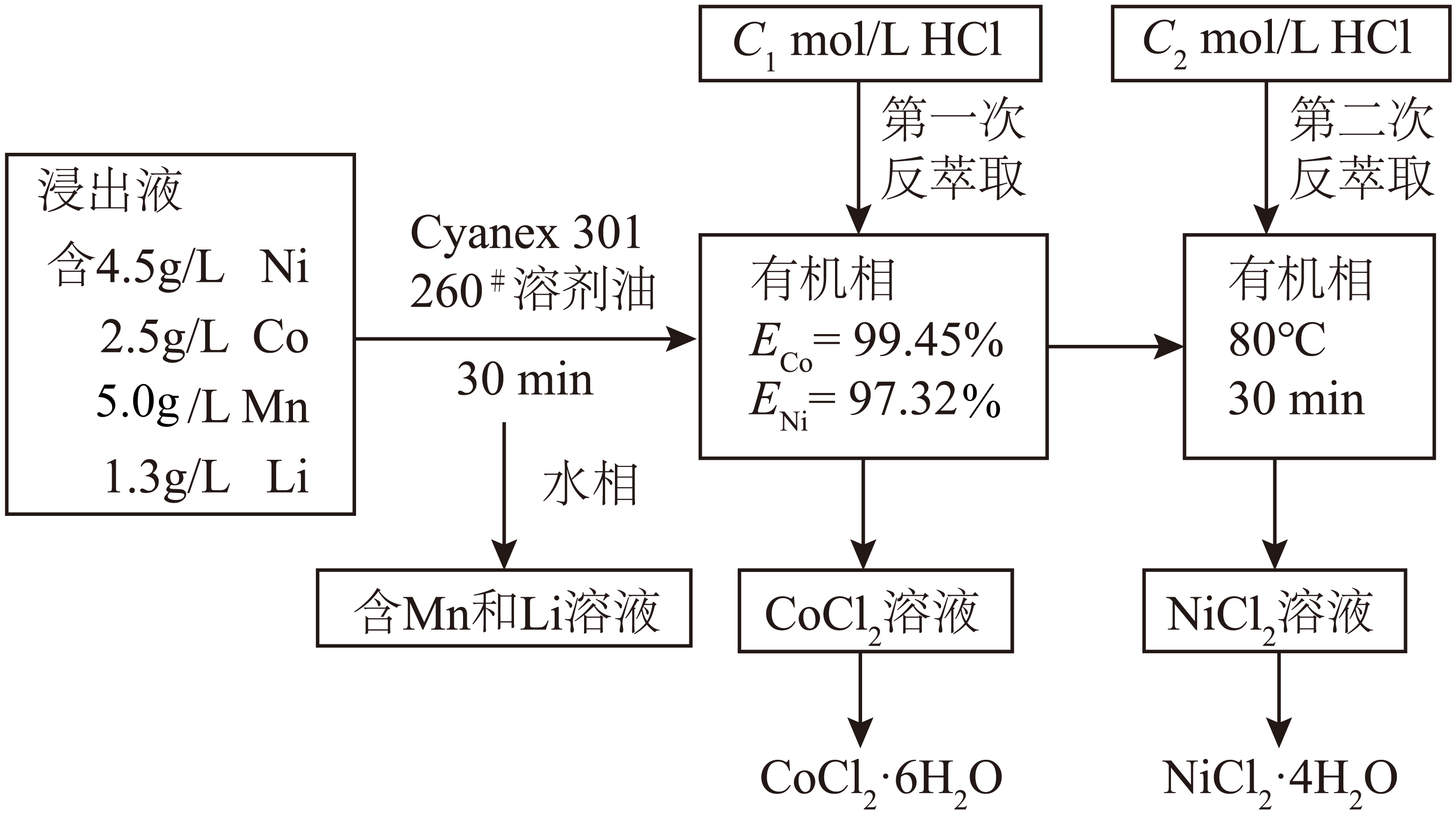
回答下列问题:
$\rm Co$在周期表中的位置 。
第四周期第Ⅷ族
"]]$\rm Co$为$\rm 27$号元素,在周期表中的位置:第四周期第Ⅷ族;
水相经加碱调节$\text{pH}$后,通入空气可将$\text{M}{{\text{n}}^{2+}}$氧化成固体氧化物,从而实现分离,写出反应的离子方程式 。
$2\\text{M}{{\\text{n}}^{2+}}+4\\text{O}{{\\text{H}}^{-}}+{{\\text{O}}_{2}}=2\\text{Mn}{{\\text{O}}_{2}}\\downarrow +2{{\\text{H}}_{2}}\\text{O}$
"]]空气中氧气具有氧化性,可将$\text{M}{{\text{n}}^{2+}}$氧化成固体氧化物二氧化锰,反应为:$2\text{M}{{\text{n}}^{2+}}+4\text{O}{{\text{H}}^{-}}+{{\text{O}}_{2}}=2\text{Mn}{{\text{O}}_{2}}\downarrow +2{{\text{H}}_{2}}\text{O}$;
$\text{Co}{{\left( \text{OH} \right)}_{3}}$遇到氨性溶液(由$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$、${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{S}{{\text{O}}_{3}}$和${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{C}{{\text{O}}_{3}}$配制)会转化为${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}}$,此时氧化剂与还原剂的物质的量之比为 。
$2:1$
"]]反应中$\rm Co$由$\rm +3$变为$\rm +2$为氧化剂,硫化合价由$\rm +4$变为$\rm +6$为还原剂,结合电子守恒:$\text{2Co}{{\left( \text{OH} \right)}_{3}}\sim 2{{\text{e}}^{-}}\sim \text{SO}_{\text{3}}^{ {2-}}$,氧化剂与还原剂的物质的量之比为$\rm 2:1$;
$\rm Cyanex\;\rm 301$是一种酸性萃取剂,其与金属离子的萃取反应可简易表示为:$\text{M}{{\text{e}}^{n+}}\left( \text{aq} \right)+m\text{HL}\left(有机相 \right)=\left[ \text{Me}\left( \text{HL} \right)m-n{{\text{L}}_{n}} \right]\left( 有机相\right)+n{{\text{H}}^{+}}$式中:$\text{Me}$为被萃金属离子;$\text{HL}$为萃取剂$\rm Cyanex\;\rm 301$,结合下图第一次反萃取过程中$\rm HCl$的浓度应为 $\rm mol/L$,简述选择此浓度的原因 。
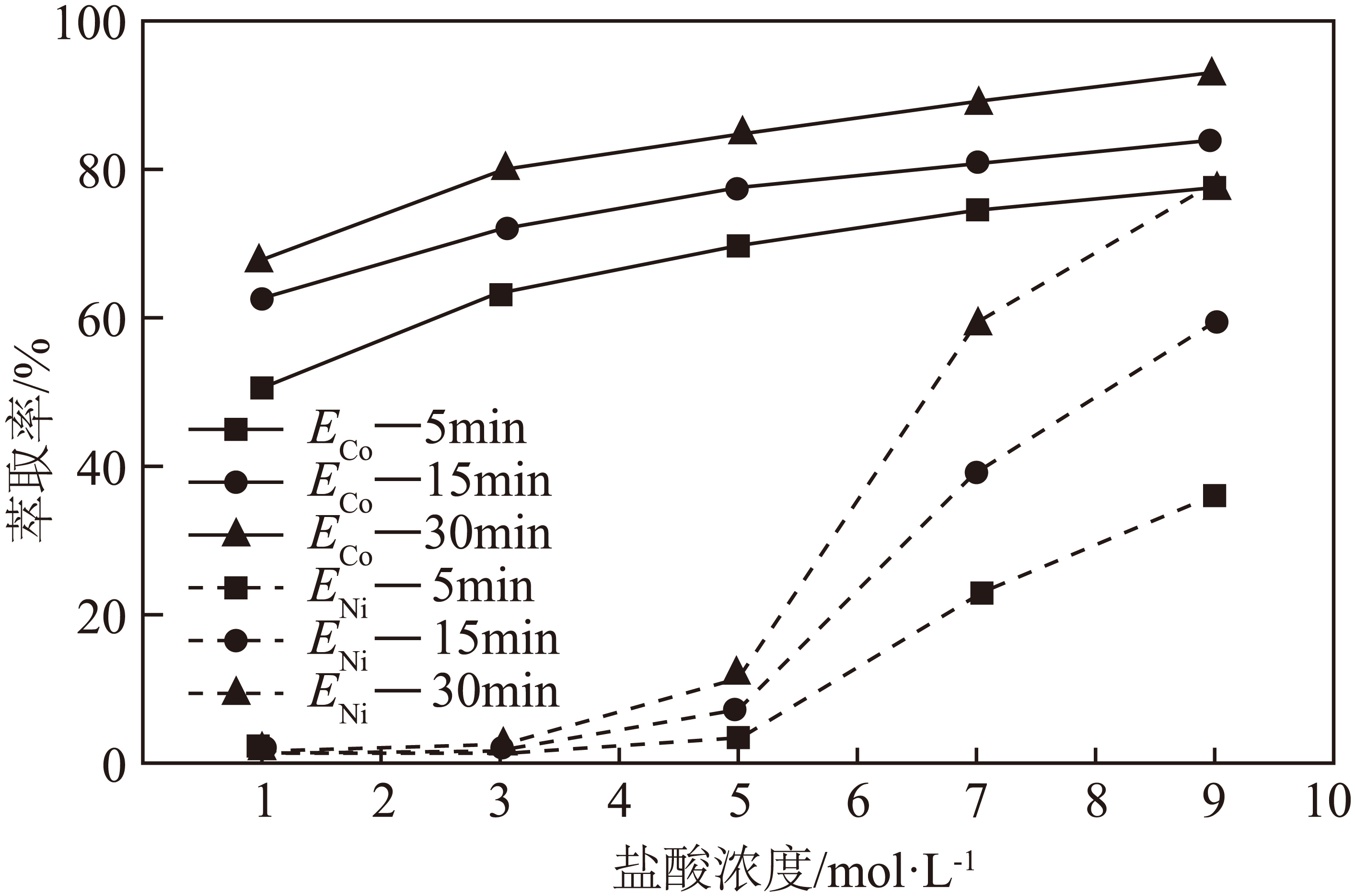
$\\rm 3$;$\\text{HCl}$浓度为$3\\;\\rm \\text{mol}/\\text{L}$时主要萃取出的为$\\text{Co}$,此时$\\text{Ni}$基本没有被萃取出来,便于分离出$\\text{Co}$和$\\text{Ni}$
"]]由图,$\text{HCl}$浓度为$3\;\rm \text{mol}/\text{L}$时主要萃取出的为$\text{Co}$,此时$\text{Ni}$基本没有被萃取出来,便于分离出$\text{Co}$和$\text{Ni}$,故第一次反萃取过程中$\rm HCl$的浓度应为$\rm 3\;\rm mol/L$;
提纯的镍和钴可用于制取镍四甲基酞箐与钴四氨基酞箐双位点电催化剂,下图中镍的化合价为 。
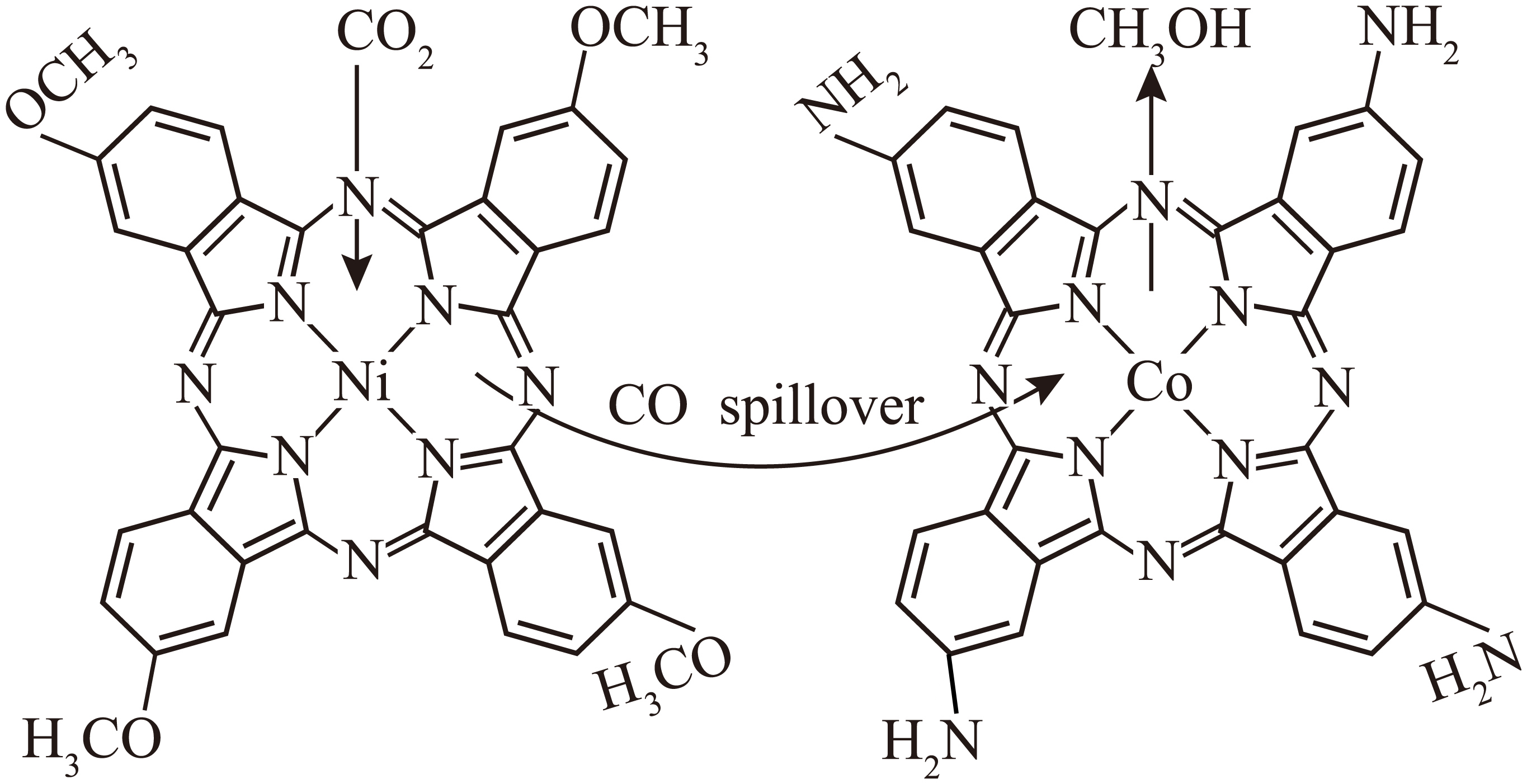
$\\rm +2$
"]]图中二氧化碳得到$\rm 2$个电子被还原为$\rm CO$,图中镍会失去$\rm 2$个电子而显$\rm +2$价;
从$\text{NiC}{{\text{l}}_{2}}$溶液中获取干燥的$\text{NiC}{{\text{l}}_{2}}\cdot 4{{\text{H}}_{2}}\text{O}$晶体的操作步骤为 。
在氯化氢气流中蒸发浓缩、冷却结晶、过滤、洗涤、干燥
"]]蒸发过程中$\text{NiC}{{\text{l}}_{2}}$会水解,则应在$\rm HCl$氛围中抑制其水解,故$\text{NiC}{{\text{l}}_{2}}$溶液中获取干燥的$\text{NiC}{{\text{l}}_{2}}\cdot 4{{\text{H}}_{2}}\text{O}$晶体的操作步骤为在氯化氢气流中蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
由$\text{CoC}{{\text{l}}_{2}}$等物质可制备$\text{A}{{\text{l}}_{ {x}}}\text{Co}{{\text{O}}_{ {y}}}$晶体,其立方晶胞如图所示。$\text{Al}$与$\mathrm{O}$最小间距大于$\text{Co}$与$\mathrm{O}$最小间距,$ {x}$、$ {y}$为整数。则$\text{Co}$在晶胞中的位置为 ;晶体中一个$\rm Al$周围与其最近的$\rm O$的个数为 。
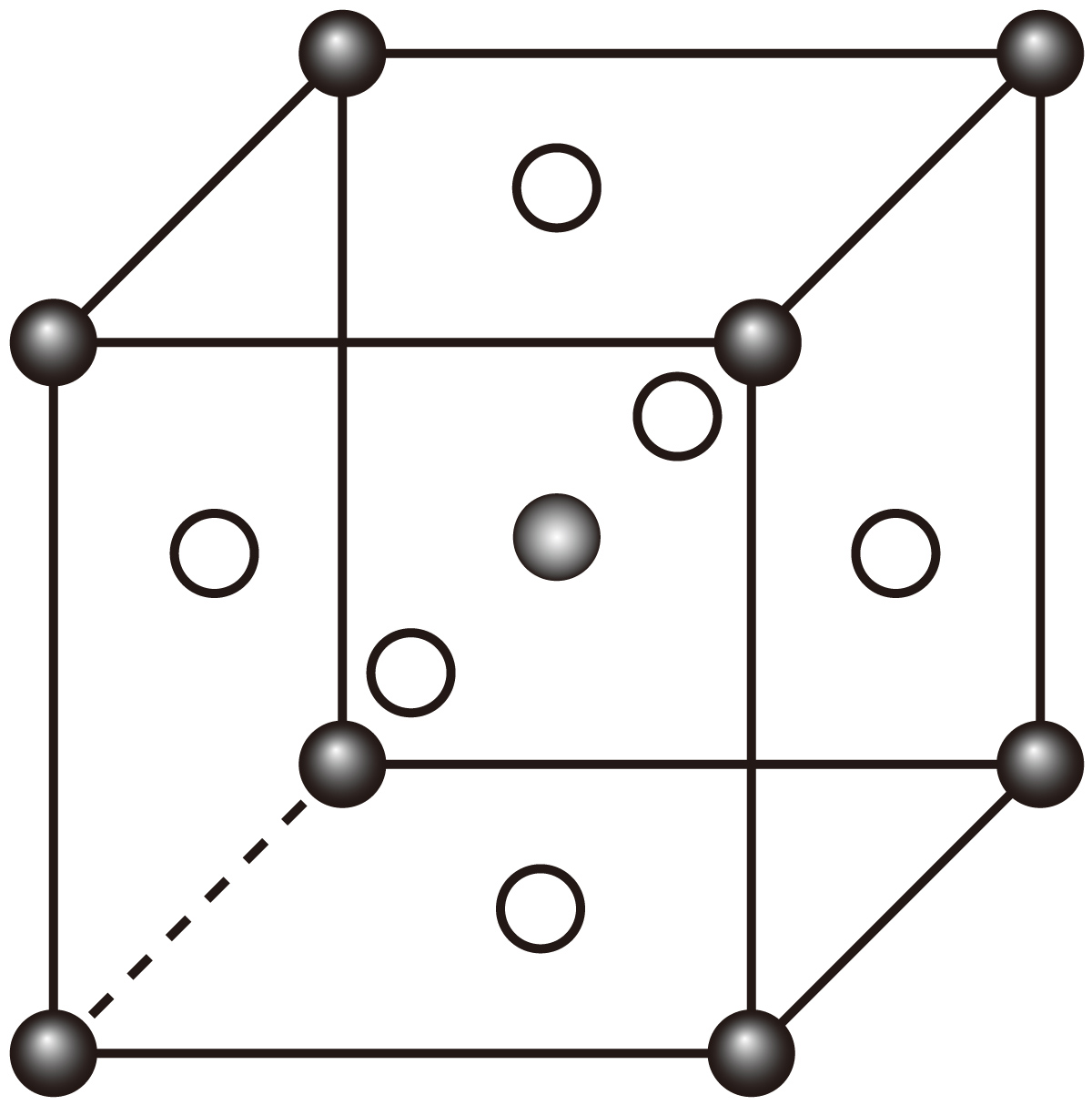
体心;$\\rm 12$
"]]根据化学式$\text{A}{{\text{l}}_{ {x}}}\text{Co}{{\text{O}}_{ {y}}}$,结合化合价代数和为$\rm 0$,氧原子数大于铝,则图中白球为氧,$\text{Al}$与$\mathrm{O}$最小间距大于$\text{Co}$与$\mathrm{O}$最小间距,则体心球为$\rm Co$,顶点黑球为$\rm Al$;晶体中$\rm Al$在顶点、氧在面心,则一个$\rm Al$周围与其最近的$\rm O$的个数为$\rm 12$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
