高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
铜在自然界大多以硫化物形式成矿。请回答:
有关铜和硫的说法正确的是$\rm (\quad\ \ \ \ )$。
基态硫原子有$\\rm 7$对成对电子
","铜焰色试验呈绿色,与铜原子核外电子跃迁释放能量有关
","基态铜原子失去$\\rm 2$个电子,$\\rm \\text{3d}$轨道形成全充满结构
","配位键强度:$\\rm {{\\left[ \\text{Cu}\\left( \\text{N}{{\\text{H}}_{3}} \\right) \\right]}^{2+}}\\gt {{\\left[ \\text{Cu}\\left( \\text{N}{{\\text{H}}_{3}} \\right) \\right]}^{+}}$
"]$\rm A$.硫原子的原子序数为$\rm 16$,其基态电子排布为$\rm :1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}$,其中,$\rm 1s$、$\rm 2s$、$\rm 2p$、$\rm 3s$轨道中的电子都是成对的,共$\rm 6$对,$\rm 3p$轨道中有$\rm 4$个电子,其中有$\rm 1$对成对电子,$\rm 2$个单电子未成对。因此,成对电子共$\rm 7$对,$\rm A$正确;
$\rm B$.焰色反应是金属离子在高温下激发,电子跃迁回基态时释放能量,以光的形式表现,$\rm B$正确;
$\rm C$.基态铜原子电子排布式为$\rm [Ar]3d^{l0}4s^{1}$,当基态铜原子失去$\rm 2$个电子时,先失去$\rm 4s$轨道的$\rm 1$个电子,再失去$\rm 3d$轨道的$\rm 1$个电子,形成$\rm :[Ar]3d^{9}$,$\rm 3d$轨道并未充满,$\rm C$错误;
$\rm D$.配位数是指中心原子周围配体的个数,$\rm \left[ \text{Cu}\left( \text{N}\text{H}_{3}\right)\right]^{2+}、\left[ \text{Cu}\left( \text{N}\text{H}_{3}\right)\right]^{+}$配位数都是$\rm 1$,但$\rm {{\left[ \text{Cu}\left( \text{N}{{\text{H}}_{3}} \right) \right]}^{2+}}$的中心铜离子电荷更高,说明中心铜离子的氧化态更高,配体结合更稳定,$\rm D$正确;
故选:$\rm ABD$
一种铜化合物的晶胞如图,写出由配离子表示的该化合物的化学式 。
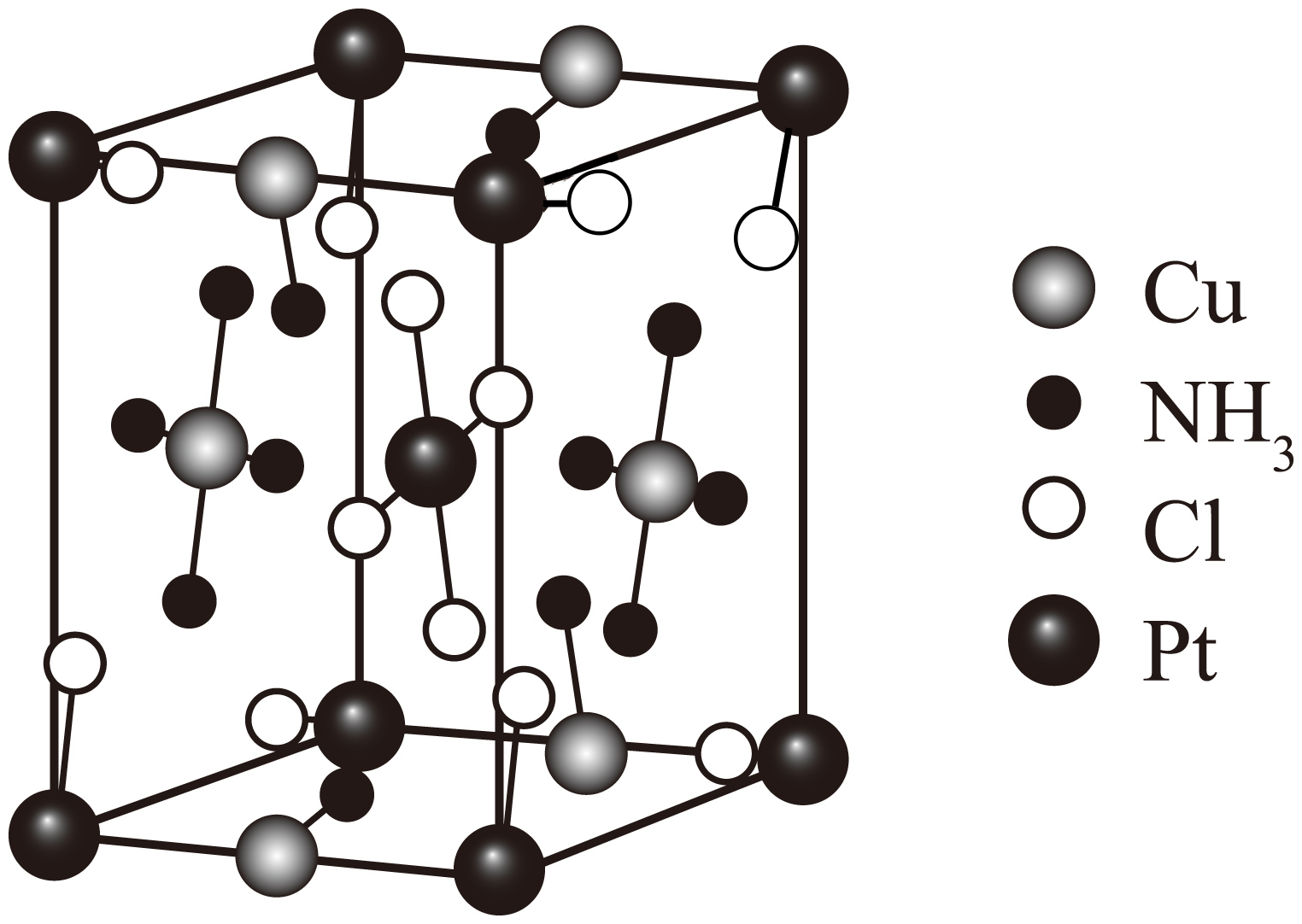
$\\rm \\left[ \\text{Cu}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{4}} \\right]\\left[ \\text{PtC}{{\\text{l}}_{4}} \\right]$
"]]根据均摊法,该铜化合物的晶胞中含$\rm Pt$:$\rm 8\times \dfrac{1}{8}+1=2$,每个$\rm Pt$周围四个$\rm Cl$配位;每个晶胞中含$\rm Cu$:$\rm 4\times \dfrac{1}{4}+2\times \dfrac{1}{2}=2$,每个$\rm Cu$周围四个$\rm NH_{3}$配位,则由配离子表示的该化合物的化学式为$\rm \left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]\left[ \text{PtC}{{\text{l}}_{4}} \right]$;
化合物$\rm A[$化学式:$\rm {{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PS}\rm ]$和$\rm B[$化学式:$\rm {{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PO}\rm ]$具有相似的结构,如图。
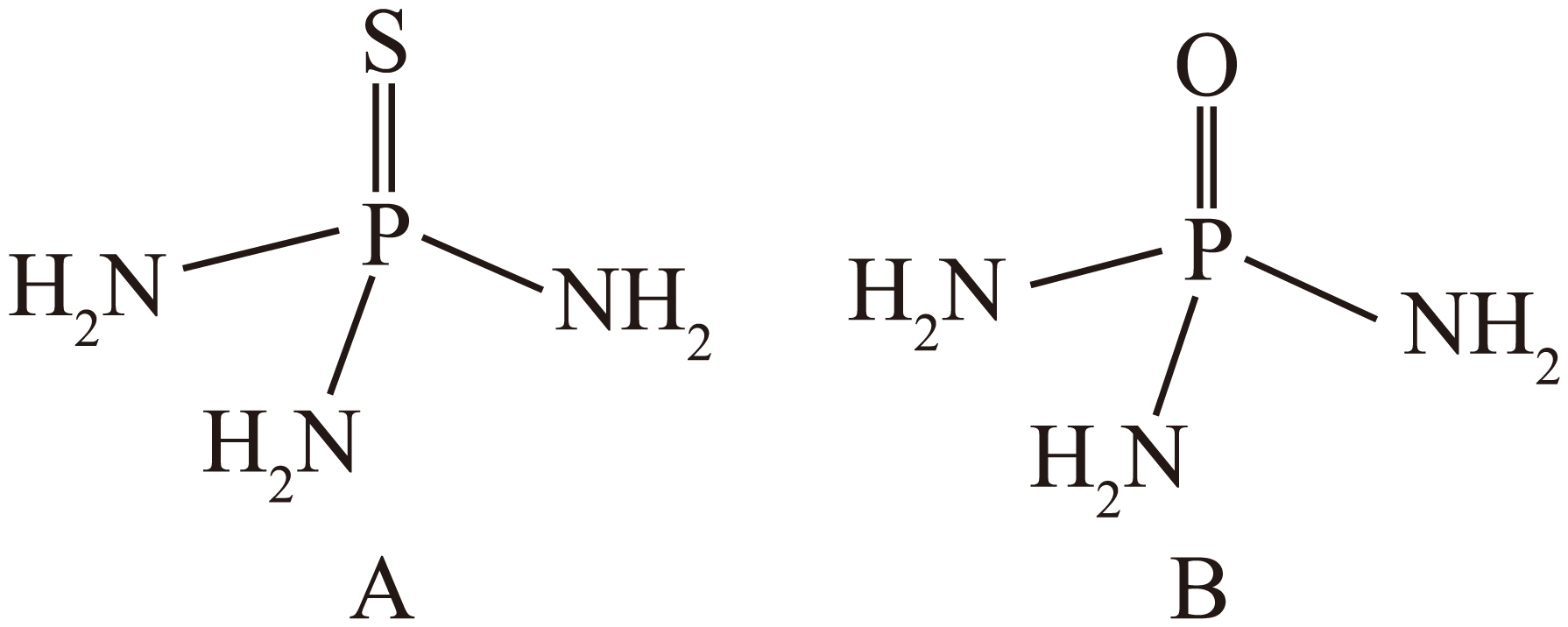
①化合物$\rm B$给出$\rm {{\text{H}}^{+}}$趋势相对更大,请从结构角度分析原因 。
②将化合物$\rm A$与足量稀硫酸混合,在加热条件下充分反应,得到气体$\rm C$和含$\rm {{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$的溶液,写出发生反应的化学方程式 。
③设计实验检验气体$\rm C$ $\rm ($要求利用气体$\rm C$的氧化性或还原性$\rm )$。
化合物$\\rm A$与化合物$\\rm B$结构相似,氧元素的电负性大于硫元素的电负性,在化合物$\\rm B$中$\\rm N-H$键的极性更强,更易断裂 ;
$\\rm 2{{\\left( {{\\text{H}}_{2}}\\text{N} \\right)}_{3}}\\text{PS}$ $\\rm +3H_{2}SO_{4}$ $\\rm +$ $\\rm 8H_{2}O$ $\\begin{array}{c} {\\underline{\\underline{\\triangle}}}\\\\{} \\end{array}$$\\rm 2{{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}\\rm +$ $\\rm 3(NH_{4})_{2}SO_{4}$ $\\rm +2$ $\\rm H_{2}S↑$;或$\\rm {{\\left( {{\\text{H}}_{2}}\\text{N} \\right)}_{3}}\\text{PS}$ $\\rm +3H_{2}SO_{4}$ $\\rm +$ $\\rm 4H_{2}O$ $\\begin{array}{c} {\\underline{\\underline{\\triangle}}}\\\\{} \\end{array}{{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}\\rm +$ $\\rm 3NH_{4}HSO_{4}$ $\\rm +$ $\\rm H_{2}S↑$ ;
将气体$\\rm C$通入少量酸性$\\rm KMnO_{4}$溶液中,若酸性$\\rm KMnO_{4}$溶液褪色,生成淡黄色沉淀,证明气体$\\rm C$是$\\rm H_{2}S($或将气体$\\rm C$与通入少量氯水中,氯水褪色,生成淡黄色沉淀,证明气体$\\rm C$是$\\rm H_{2}S)$
"]]①化合物$\rm A$与化合物$\rm B$结构相似,氧元素的电负性大于硫元素的电负性,在化合物$\rm B{{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PO}$中,$\rm N-H$键的极性更强,更易断裂,给出$\rm {{\text{H}}^{+}}$趋势相对更大;
②化合物$\rm A[$化学式:$\rm {{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PS}\rm ]$与足量稀硫酸混合,$\rm {{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PS}$中$\rm P$元素为$\rm +5$价,$\rm S$元素为$\rm -2$价,反应过程中各元素化合价未发生变化,在加热条件下反应,生成$\rm {{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$、$\rm H_{2}S$气体和$\rm (NH_{4})_{2}SO_{4}$,化学方程式为:$\rm 2{{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PS}$ $\rm +3H_{2}SO_{4}$ $\rm +$ $\rm 8H_{2}O$ $\begin{array}{c} {\underline{\underline{\triangle}}}\\{} \end{array}$$\rm 2{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\rm +$ $\rm 3(NH_{4})_{2}SO_{4}$ $\rm +2$ $\rm H_{2}S↑$;或$\rm {{\left( {{\text{H}}_{2}}\text{N} \right)}_{3}}\text{PS}\rm +3H_{2}SO_{4}+$ $\rm 4H_{2}O$ $\begin{array}{c} {\underline{\underline{\triangle}}}\\{} \end{array}{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\rm +$ $\rm 3NH_{4}HSO_{4}$ $\rm +$ $\rm H_{2}S↑$;
③由②可知气体$\rm C$为$\rm H_{2}S$,利用其还原性检验:将气体$\rm C$通入少量酸性$\rm KMnO_{4}$溶液中,若酸性$\rm KMnO_{4}$溶液褪色,生成淡黄色沉淀,证明气体$\rm C$是$\rm H_{2}S($或将气体$\rm C$与通入少量氯水中,氯水褪色,生成淡黄色沉淀,证明气体$\rm C$是$\rm H_{2}S)$ ;
有同学以$\rm \text{C}{{\text{u}}_{3}}\text{Fe}{{\text{S}}_{4}}$为原料,设计如下转化方案:
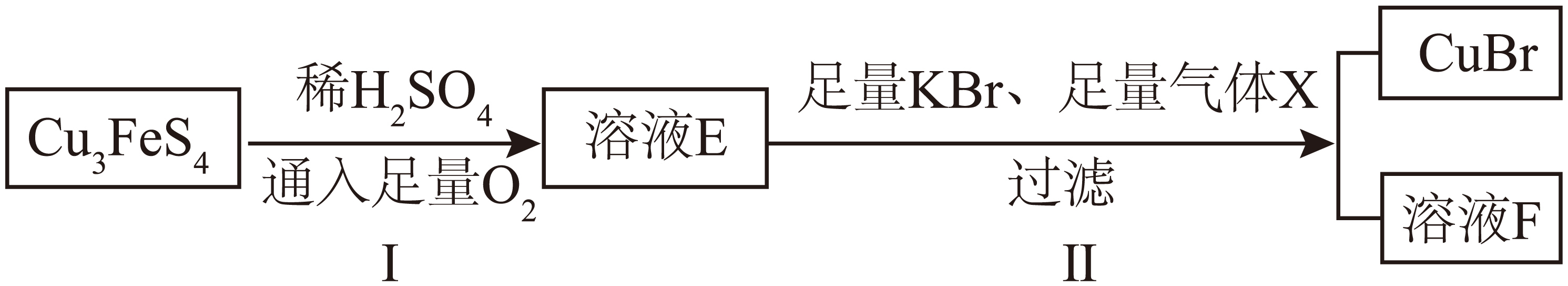
①步骤$\rm I$的化学方程式 。
②步骤Ⅱ中,溶液$\rm E$中铜元素全部转化为难溶性$\rm \text{CuBr}$。气体$\rm X$为 $\rm ($要求不引入其他新的元素$\rm )$;溶液$\rm F$中除$\rm {{\text{K}}^{+}}、{{\text{H}}^{+}}、\text{B}{{\text{r}}^{-}}$外,浓度最高的两种离子 $\rm ($按浓度由高到低顺序$\rm )$。
$\\rm 4\\text{C}{{\\text{u}}_{3}}\\text{Fe}{{\\text{S}}_{4}}\\rm +33O_{2}$ $\\rm +$ $\\rm 2H_{2}SO_{4}$ $\\rm =$ $\\rm 12CuSO_{4}$ $\\rm +$ $\\rm 2$ $\\rm Fe_{2}(SO_{4})_{3}$ $\\rm +2H_{2}O$; $\\rm SO_{2}$ ;$\\rm \\text{SO}_{4}^{2-}$、$\\rm Fe^{2+}$
"]]①步骤$\rm I$中,$\rm \text{C}{{\text{u}}_{3}}\text{Fe}{{\text{S}}_{4}}$与稀$\rm H_{2}SO_{4}$、$\rm O_{2}$发生氧化还原反应,$\rm S$元素化合价从$\rm -2$价氧化为$\rm +6$价,$\rm Fe$元素化合价从$\rm +2$价氧化为$\rm +3$价,$\rm Cu$元素保持$\rm +2$价,生成$\rm CuSO_{4}$、$\rm Fe_{2}(SO_{4})_{3}$和$\rm H_{2}O$,根据氧化还原反应的配平原则,化学方程式为$\rm :4\text{C}{{\text{u}}_{3}}\text{Fe}{{\text{S}}_{4}}\rm +33O_{2}$ $\rm +$ $\rm 2H_{2}SO_{4}$ $\rm =$ $\rm 12CuSO_{4}$ $\rm +$ $\rm 2$ $\rm Fe_{2}(SO_{4})_{3}$ $\rm +2H_{2}O$;
②步骤Ⅱ中要将溶液$\rm E($含$\rm Cu^{2+}$等$\rm )$中的铜元素全部转化为$\rm CuBr$,且不引入新元素,结合反应中元素化合价变化,$\rm Cu^{2+}$被还原为$\rm Cu^{+}($存在于$\rm CuBr$中$\rm )$,需要加入具有还原性的气体,所以气体$\rm X$为$\rm SO_{2}$。溶液$\rm E$中的$\rm Fe^{3+}$与$\rm SO_{2}$发生反应$\rm 2Fe^{3+}+SO_{2}+2H_{2}O=2Fe^{2+}+\text{SO}_{4}^{2-}\rm +4H^{+}$,同时溶液$\rm E$中的$\rm CuSO_{4}$、$\rm Fe_{2}(SO_{4})_{3}$还有大量的$\rm \text{SO}_{4}^{2-}$,所以溶液$\rm F$除含$\rm K^{+}$、$\rm H^{+}$、$\rm Br^{-}$外,浓度最高的两种离子为$\rm \text{SO}_{4}^{2-}$、$\rm Fe^{2+}$。
高中 | 配合物理论题目答案及解析(完整版)
