高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
三氯化六氨合钴(Ⅲ)$\left\{ \left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}} \right\}$是一种广泛使用的有机合成反应催化剂,实验室利用反应:$10\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}+2\text{CoC}{{\text{l}}_{2}}+2\text{N}{{\text{H}}_{4}}\text{Cl}+{{\text{H}}_{2}}{{\text{O}}_{2}}\begin{matrix} \underline{\underline{55\sim60\;{}^\circ \text{C}}} \\ 活性炭\\ \end{matrix}2\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}+12{{\text{H}}_{2}}\text{O}$制取三氯化六氨合钴(Ⅲ)的装置如下图:
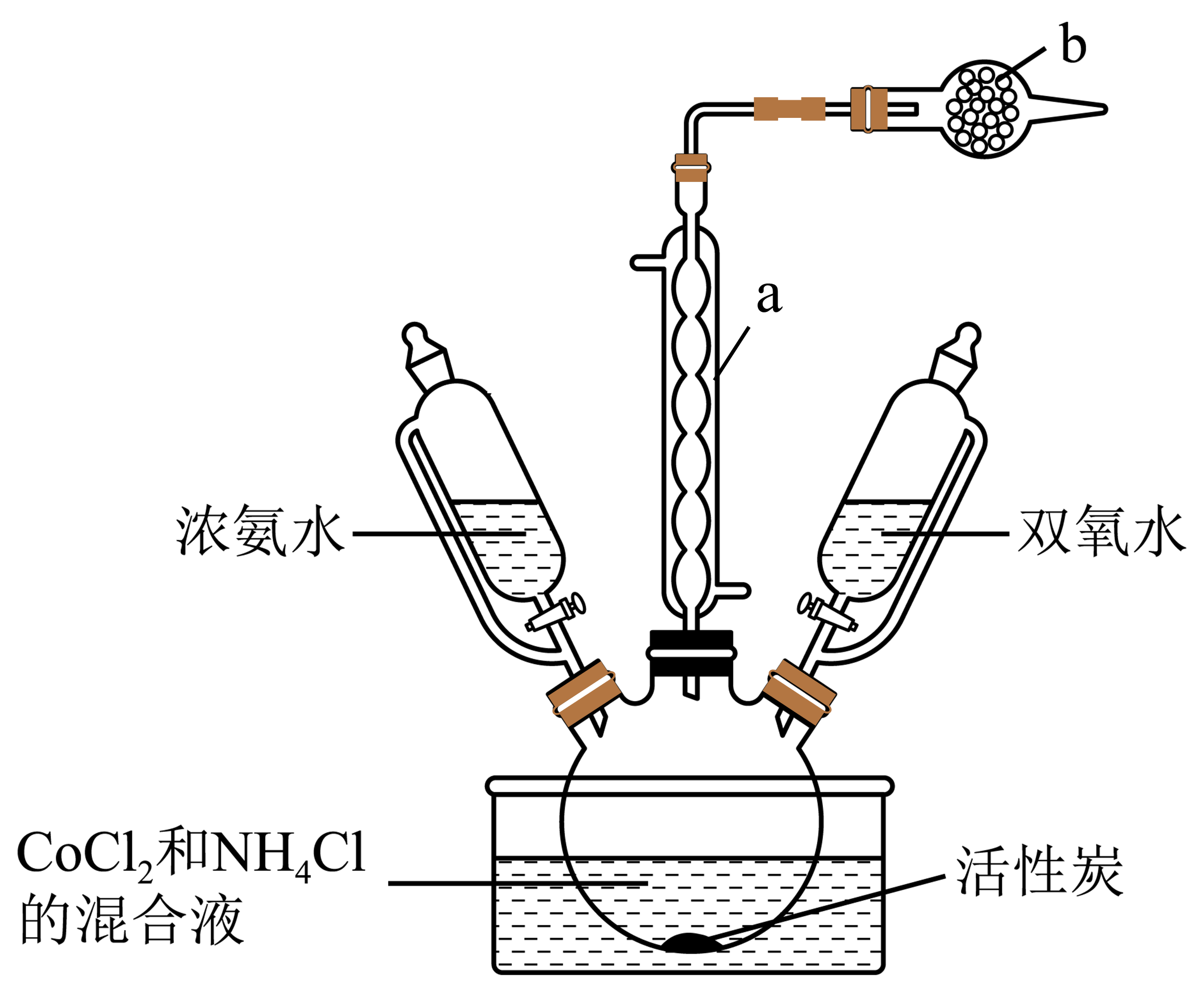
已知:①${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}}$呈棕色,${{K}_{\text{sp}}}\left[ \text{Co}{{\left( \text{OH} \right)}_{2}} \right]=6\times {{10}^{-15}}$;
②化学上常用标准电极电势${{\varphi }^{\theta }}$(氧化态/还原态)比较物质的氧化能力。${{\varphi }^{\theta }}$值越高,氧化态物种氧化能力越强,${{\varphi }^{\theta }}\left| {{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{3+}}/{{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}} \right|=0.1\text{ V}$,${{\varphi }^{\theta }}\left( \text{C}{{\text{o}}^{3+}}/\text{C}{{\text{o}}^{2+}} \right)=1.84\text{ V}$;
③$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$晶体呈橘黄色,可溶于热水,微溶于冷水,难溶于乙醇。
实验步骤如下:
Ⅰ.制备三氯化六氨合钴(Ⅲ)
①将$3.0\text{ g CoC}{{\text{l}}_{2}}\cdot 6{{\text{H}}_{2}}\text{O}$晶体和$2.0\text{ g N}{{\text{H}}_{4}}\text{Cl}$溶解后,转入三颈烧瓶,控制温度在$\rm 10\;\rm ^\circ\rm C$以下,加入$\rm 7.0\;\rm mL$浓氨水,充分反应后溶液变为棕色。
②缓慢滴加$\rm 7.0\;\rm mL\;\rm 5\%$双氧水,水浴控制温度$\rm 55\sim 60\;\rm ^\circ\rm C$,恒温反应$\rm 20\;\rm min$。
③用冰水浴冷却至$\rm 2\;\rm ^\circ\rm C$左右,进行抽滤,收集固体粗产品。
④将粗产品溶于$\rm 30.0\;\rm mL$稀盐酸中,加热,待固体充分溶解后趁热过滤,向溶液中加入$\rm 4.0\;\rm mL$浓盐酸,冰水冷却,使晶体充分析出,抽淲,洗涤,干燥。
Ⅱ.测定产品的纯度
①取$\rm 0.500\;\rm g$产品加入锥形瓶中,加入足量$\text{NaOH}$溶液并加热,将$\text{N}{{\text{H}}_{3}}$蒸出后,加入足量的稀硫酸酸化,使$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$全部转化为$\text{C}{{\text{o}}^{3+}}$后,加适量水稀释,加入过量的$\text{KI}$浴液,再用$\rm 0.100\text{ mol}\cdot {{\text{L}}^{-1}}\text{ N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$标准溶液滴定,消耗$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$标准溶液$\rm 18.00\;\rm mL$。反应原理为$2\text{C}{{\text{o}}^{3+}}+2{{\text{I}}^{-}}=2\text{C}{{\text{o}}^{2+}}+{{\text{I}}_{2}}$,${{\text{I}}_{2}}+2{{\text{S}}_{2}}\text{O}_{3}^{2-}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$。
②空白试验校正:另取与上述滴定过程等量的$\text{KI}$溶液于锥形瓶中,用$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$标准溶液滴定,消耗$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$标准溶液$\rm 1.00\;\rm mL$。
仪器$\rm a$的名称为 。仪器$\rm b$中试剂为 (填写化学式)。
球形冷凝管;$\\rm \\text{CaC}{{\\text{l}}_{2}}$($\\rm {{\\text{P}}_{2}}{{\\text{O}}_{5}}$等)
"]]仪器$\rm a$的名称为球形冷凝管;仪器$\rm b$是尾气吸收装置,试剂为$\rm \text{CaC}{{\text{l}}_{2}}$($\rm {{\text{P}}_{2}}{{\text{O}}_{5}}$等);
向混合液中先加入浓氨水,目的是 。
将$\\text{C}{{\\text{o}}^{2+}}$转化为易被氧化的${{\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_3} \\right)}_6} \\right]}^{2+}}$
"]]因$\rm {{\varphi}^{{ }\theta}}$值越高,氧化态物种氧化能力越强,$\rm {{{ }\varphi}^{\theta}}\left| \dfrac{{{\left[ {Co}{{\left( {N}{{{H}}_{{3}}} \right)}_{{6}}} \right]}^{{3+}}}}{{{\left[ {Co}{{\left( {N}{{{H}}_{{3}}} \right)}_{{6}}} \right]}^{{2+}}}} \right|{=0}{.1\;V}$,$\rm {{{ }\varphi}^{\theta}}\left( \dfrac{{C}{{{o}}^{{3+}}}}{{C}{{{o}}^{{2+}}}} \right){=1}{.84\;V}$,先加入浓氨水,将$\rm {C}{{{o}}^{2+}}$转化为易被氧化的$\rm {{\left[ {Co}{{\left( {N}{{{H}}_3} \right)}_6} \right]}^{2+}}$,为下一步反应做好准备;
以下对$\text{N}{{\text{H}}_{4}}\text{Cl}$在反应中所起作用的认识错误的是$(\quad\ \ \ \ )$(填字母)。
能够抑制$\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}$电离,控制$\\rm pH$
","能够促进$\\text{C}{{\\text{o}}^{2+}}$水解,有利于配合物形成
","能够抑制$\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}$电离,增加$\\text{N}{{\\text{H}}_{3}}$㳖度,有利于配合物形成
"]$\rm A$.$\text{N}{{\text{H}}_{4}}\text{Cl}$,电离能够产生铵根离子,能够抑制$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$电离,控制$\rm pH$,防止$\text{O}{{\text{H}}^{-}}$浓度过大$\rm Co^{2+}$生成沉淀,$\rm A$正确;
$\rm B$.$\rm NH_{4}Cl$是强酸弱碱盐,可以抑制$\rm CoCl_{2}$在溶液中$\text{C}{{\text{o}}^{2+}}$的水解,有利于配合物形成,$\rm B$错误;
$\rm C$.能够抑制$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$电离,增加$\text{N}{{\text{H}}_{3}}$㳖度,后续$\rm Co^{2+}$与$\rm NH_{3}$的配合反应,$\rm C$正确;
故选:$\rm B$;
步骤④中加入浓盐酸的作用为 。
增大氯离子浓度,降低$\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{6}} \\right]\\text{C}{{\\text{l}}_{3}}$的溶解度,有利于其结晶析出
"]]步骤④中加入浓盐酸,增大氯离子浓度,使$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$的沉淀溶解平衡逆向进行,降低$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$的溶解度,有利于其结晶析出;
抽滤装置如图所示,抽滤完毕的后续操作为$(\quad\ \ \ \ )$(填字母)。
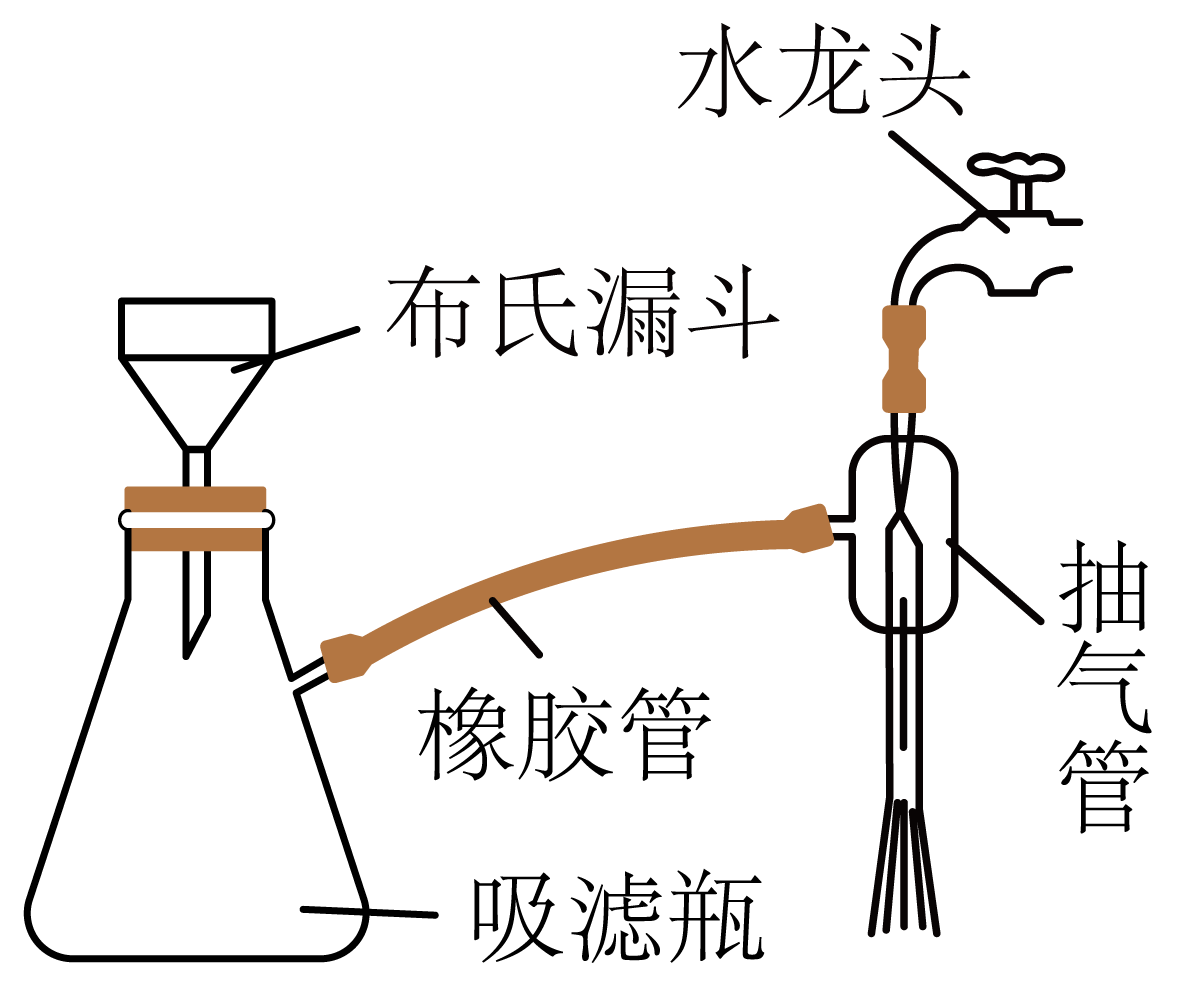
先关闭水龙头,后拔掉橡胶管
","先拔掉橡胶管,后关闭水龙头
"]抽滤完毕后,为防止自来水进入吸滤瓶中,接下来的操作为先拔掉橡胶管,后关闭水龙头,故选:$\rm B$;
滴定时选用的指示剂为淀粉溶液,滴定终点现象为 。设计空白试验校正的原因为 。产品的纯度为 。
最后半滴$\\text{N}{{\\text{a}}_{2}}{{\\text{S}}_{2}}{{\\text{O}}_{3}}$标准溶液滴入,溶液由蓝色变为无色,且半分钟不恢复原色;排除碘化钾在保存或实验过程中被氧化产生微量${{\\text{I}}_{2}}$对滴定实验的影响;$\\rm 90.95\\%$
"]]用$\rm {N}{{{a}}_{{2}}}{{{S}}_{{2}}}{{{O}}_{{3}}}$滴定生成的$\rm I_{2}$时应选用淀粉溶液做指示剂,滴定终点现象为:最后半滴$\rm {N}{{{a}}_{2}}{{{S}}_{2}}{{{O}}_{3}}$标准溶液滴入,溶液由蓝色变为无色,且半分钟不恢复原色;设计空白试验校正的原因:排除碘化钾在保存或实验过程中被氧化产生微量$\rm {{{I}}_{2}}$对滴定实验的影响为;根据反应可得到关系式为$\rm {2C}{{{o}}^{{3+}}}\sim {{{I}}_{{2}}}\sim 2{{{S}}_{{2}}}{O}_{{3}}^{{2-}}$,${n(}\left[ {\rm Co}{{\left(\rm {N}{{{H}}_{{3}}} \right)}_{{6}}} \right]{\rm C}{{\rm {l}}_{{3}}}{)}={n\rm (C}{{\rm {o}}^{{3+}}}{)=0}{.100\;\rm mol/L}\times {18}\times {1}{{{0}}^{{-3}}}{\rm \;L=1}{.8}\times {1}{{{0}}^{{-3}}}\rm \;{mol}$,则产品的纯度为$\dfrac{{1}{.8}\times {1}{{{0}}^{{-3}}}\rm \;{mol}\times {267}{.5\;\rm g/mol}}{{0}{.500\;\rm g}}\times {100 }\%{ =96}{.3 }\%$。
高中 | 配合物理论题目答案及解析(完整版)
