高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
某兴趣小组用$\rm KMn{{O}_{4}}$和浓盐酸制取氯气并探究氯、溴、碘的相关性质,设计装置图如下所示(夹持装置已略去)。下列说法错误的是$(\qquad)$
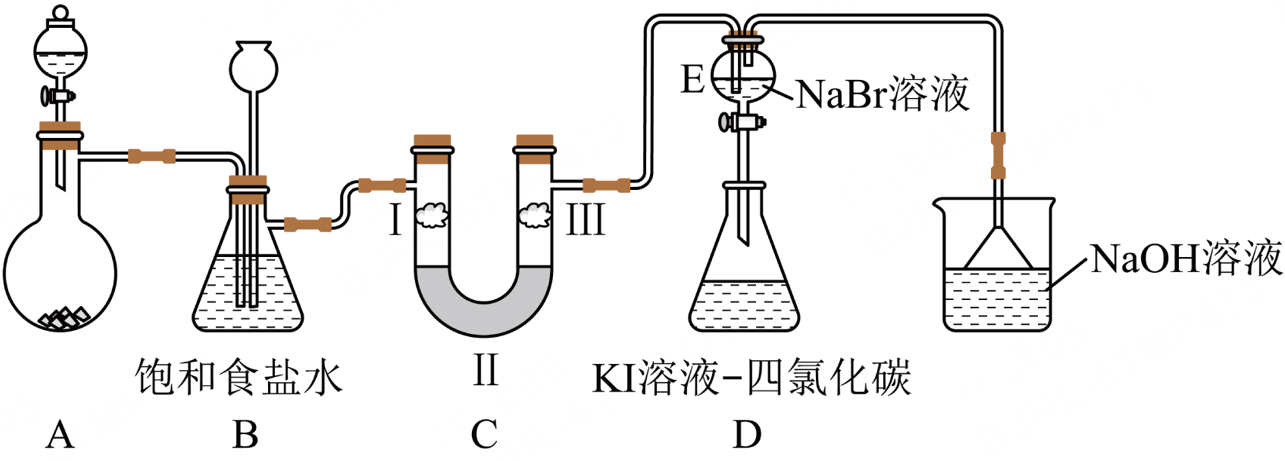
装置$\\rm A$中发生反应的离子方程式:$\\rm 2MnO_{4}^{-}+10C{{l}^{-}}+16{{H}^{+}}=2M{{n}^{2+}}+5C{{l}_{2}}\\uparrow +8{{H}_{2}}O$
","若装置$\\rm C$发生堵塞,$\\rm B$中长颈漏斗内液面会上升
","为验证氯气是否具有漂白性,Ⅰ、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙、干燥的有色布条
","通入足量的氯气,将$\\rm E$中溶液滴入$\\rm D$中,振荡后锥形瓶下层液体呈紫色即可证明氧化性$\\rm B{{r}_{2}}\\gt {{I}_{2}}$
"]常温下$\rm KMn{{O}_{4}}$和浓盐酸在$\rm A$中反应生成氯气,浓盐酸具有挥发性,导致生成的氯气中含有$\rm HCl$,用饱和食盐水除去氯气中$\rm HCl$,氯气没有漂白性但次氯酸有漂白性,氯气和溴化钠反应生成溴,溴能和$\rm KI$反应生成碘单质,氯气有毒不能排空,应该用$\rm NaOH$溶液处理尾气。
A.装置$\rm A$中高锰酸根离子和氯离子发生氧化还原反应生成氯气和锰离子,发生反应的离子方程式:$\rm 2MnO_{4}^{-}+10C{{l}^{-}}+16{{H}^{+}}=2M{{n}^{2+}}+5C{{l}_{2}}\uparrow +8{{H}_{2}}O$,故A正确;
B.若装置$\rm C$发生堵塞,则装置$\rm B$中压强增大,因此长颈漏斗内液面会上升,故B正确;
C.要验证氯气没有漂白性,应该用干燥剂干燥氯气然后用干燥的红色布条检验,则为了验证氯气是否具有漂白性,Ⅰ、Ⅱ、Ⅲ分别放置湿润的有色布条、无水氯化钙、干燥的有色布条,故C正确;
D.将氯气通入溴化钠溶液中,导致溶液中可能含有氯气,氯气也能氧化碘离子生成碘,导致干扰实验,所以若观察到锥形瓶下层液体呈紫红色,不能证明氧化性,故D错误。
故选:D
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
