高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\text{Mn}{{\text{O}}_{2}}$是锌锰电池的正极材料,${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$是一种绿色净水剂。以某锰矿$\rm ($主要成分是$\text{Mn}{{\text{O}}_{2}}$,含少量$\text{Mn}$和$\text{Fe}\rm )$为原料制备$\text{Mn}{{\text{O}}_{2}}$和${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$的流程如图。
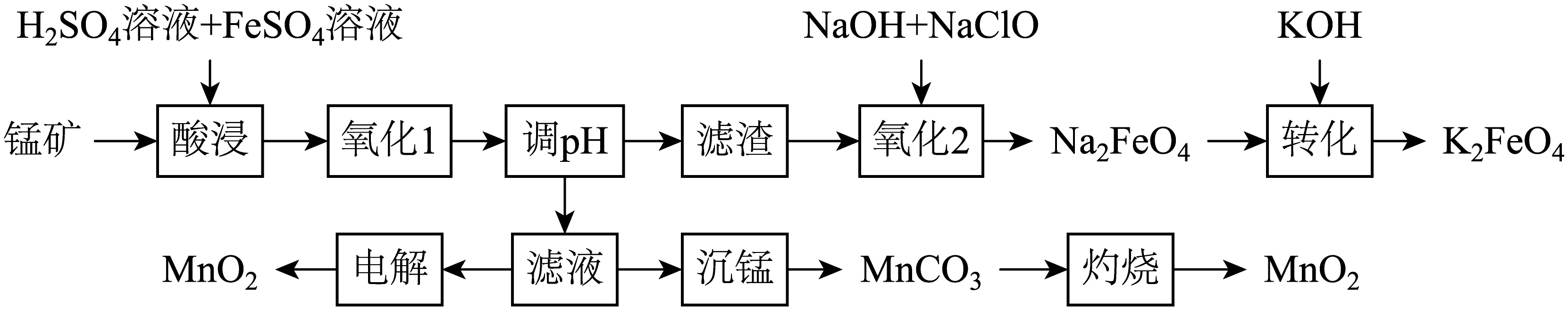
已知:部分金属离子在溶液中沉淀的$\text{pH}$如表所示。
| 金属离子 | $\text{F}{{\text{e}}^{3+}}$ | $\text{F}{{\text{e}}^{2+}}$ | $\text{M}{{\text{n}}^{2+}}$ |
| 开始沉淀的$\text{pH}$ | $\rm 1.9$ | $\rm 7.0$ | $\rm 8.1$ |
| 完全沉淀的$\text{pH}$ | $\rm 3.2$ | $\rm 9.0$ | $\rm 10.1$ |
回答下列问题:
$\text{Mn}$和$\text{Fe}$两元素的部分电离能数据如表所示。
| 元素 | $\text{Mn}$ | $\text{Fe}$ | |
| 电离能$/\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ | ${{ {I}}_{\text{1}}}$ | $\rm 717$ | $\rm 759$ |
| ${{ {I}}_{\text{2}}}$ | $\rm 1509$ | $\rm 1561$ | |
| ${{ {I}}_{\text{3}}}$ | $\rm 3248$ | $\rm 2957$ | |
$\text{Mn}$的第三电离能大于铁的第三电离能,其主要原因是 。
基态$\\text{M}{{\\text{n}}^{2+}}$、$\\text{F}{{\\text{e}}^{2+}}$的价层电子排布式分别为$3{{\\text{d}}^{5}}3{{\\text{d}}^{6}}$,基态$\\text{M}{{\\text{n}}^{2+}}$达到半充满稳定结构,再失去$\\rm 1$个电子较难,而基态$\\text{F}{{\\text{e}}^{2+}}$再失去$\\rm 1$个电子达到半充满结构,较容易
"]]基态$\text{M}{{\text{n}}^{2+}}$、$\text{F}{{\text{e}}^{2+}}$的价层电子排布式分别为$3{{\text{d}}^{5}}3{{\text{d}}^{6}}$,基态$\text{M}{{\text{n}}^{2+}}$达到半充满稳定结构,再失去$\rm 1$个电子较难,而基态$\text{F}{{\text{e}}^{2+}}$再失去$\rm 1$个电子达到半充满结构,失电子较容易,所以$\text{Mn}$的第三电离能大于铁的第三电离能;
提高“酸浸”速率的措施有 $\rm ($填一条即可$\rm )$。
粉碎矿石或增大反应物浓度或适当加热或搅拌等
"]]根据影响反应速率的因素,提高“酸浸”速率的措施有粉碎矿石、增大反应物浓度、适当加热、搅拌等;
“调$\text{pH}$”的范围为 ,“转化”的原理是 。
$3.2 \\leqslant \\mathrm{pH}\\lt 8.1$;${{\\text{K}}_{2}}\\text{Fe}{{\\text{O}}_{4}}$的溶解度小于$\\text{N}{{\\text{a}}_{2}}\\text{Fe}{{\\text{O}}_{4}}$
"]]“调$\text{pH}$”的目的是使$\rm Fe^{3+}$完全沉淀,$\rm Mn^{2+}$不能沉淀,所以“调$\text{pH}$”范围为$3.2 \leqslant \mathrm{pH}\lt 8.1$;“转化”的原理是利用${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$的溶解度小于$\text{N}{{\text{a}}_{2}}\text{Fe}{{\text{O}}_{4}}$,$\rm Na_{2}FeO_{4}$和$\rm KOH$反应生成$\rm K_{2}FeO_{4}$沉淀。
“氧化$\rm 2$”的离子方程式为 ;${{\text{K}}_{\text{2}}}\text{Fe}{{\text{O}}_{\text{4}}}$净水时被还原成$\text{F}{{\text{e}}^{\text{3+}}}$,$\text{F}{{\text{e}}^{\text{3+}}}$水解生成$\text{Fe}{{\left( \text{OH} \right)}_{\text{3}}}$胶体,胶体不同于溶液、悬浊液、乳浊液的本质特征是 。
$2\\text{Fe}{{(\\text{OH})}_{3}}+3\\text{Cl}{{\\text{O}}^{-}}+4\\text{O}{{\\text{H}}^{-}}=2\\text{FeO}_{4}^{2-}+3\\text{C}{{\\text{l}}^{-}}+5{{\\text{H}}_{2}}\\text{O}$;分散质粒子直径在$1\\;\\rm \\text{nm}\\sim100\\;\\rm \\text{nm}$
"]]“氧化$\rm 2$”是在碱性条件下,用次氯酸钠把氢氧化铁氧化为高铁酸钠,反应的离子方程式为$2\text{Fe}{{(\text{OH})}_{3}}+3\text{Cl}{{\text{O}}^{-}}+4\text{O}{{\text{H}}^{-}}=2\text{FeO}_{4}^{2-}+3\text{C}{{\text{l}}^{-}}+5{{\text{H}}_{2}}\text{O}$;胶体不同于溶液、悬浊液、乳浊液的本质特征是分散质粒子直径在$1\;\rm \text{nm}\sim100\;\rm \text{nm}$。
“电解”会产生废液,该废液可循环用于“ ”$\rm ($填名称$\rm )$工序。
酸浸
"]]电解硫酸锰溶液生成二氧化锰、氢气、硫酸,“电解”会产生废液硫酸,该废液可循环用于“酸浸”工序。
“灼烧”中制备$\text{Mn}{{\text{O}}_{\text{2}}}$的化学方程式为 。某温度下,灼烧$\text{MnC}{{\text{O}}_{\text{3}}}$生成锰的氧化物$\rm M$,固体失重率约为$\rm 33.6\%$,则$\rm M$的化学式为 。
$2\\text{MnC}{{\\text{O}}_{3}}+{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}2\\text{Mn}{{\\text{O}}_{2}}+2\\text{C}{{\\text{O}}_{2}}$;$\\text{M}{{\\text{n}}_{3}}{{\\text{O}}_{4}}$
"]]“灼烧”中碳酸锰和氧气反应生成$\text{Mn}{{\text{O}}_{\text{2}}}$和二氧化碳,反应的化学方程式为$2\text{MnC}{{\text{O}}_{3}}+{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}2\text{Mn}{{\text{O}}_{2}}+2\text{C}{{\text{O}}_{2}}$。
设$\rm M$的化学式为${\rm Mn}_{x}{\rm O}_{y}$,根据$\rm Mn$元素守恒$ x\rm \;mol\text{ MnC}{{\text{O}}_{\text{3}}}$生成${\rm 1\;\rm mol\;\rm Mn}_{x}{\rm O}_{y}$,固体失重率约为$\rm 33.6\%$,则$\dfrac{55 {x}+16 {y}}{x\left( 55+60 \right)}=1-0.336$,$\dfrac{ {y}}{ {x}}=\dfrac{4}{3}$, $\rm M$的化学式为$\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
