高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
锆是一种稀有金属,广泛用在航空航天、军工、核反应、原子能领域。一种以锆英砂$\rm ($主要含$\text{ZrSi}{{\text{O}}_{\text{4}}}$,还含有少量$\rm Cr$、$\rm Fe$、$\rm Hf$等元素$\rm )$为原料生产金属锆和副产物硅酸钙的工艺流程如下:
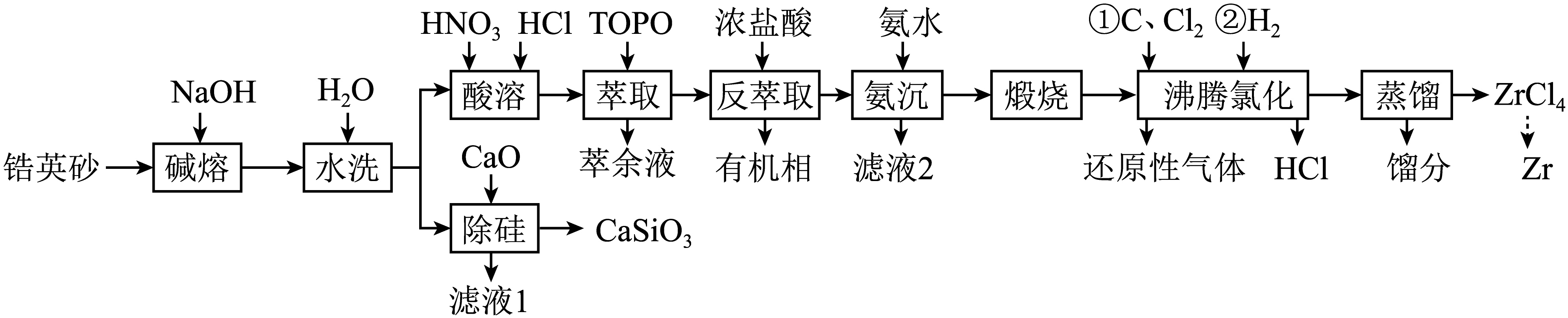
已知:①“酸溶”后各金属元素在溶液中的存在形式为$\text{Z}{{\text{r}}^{\text{4}+}}$、$\text{F}{{\text{e}}^{\text{3}+}}$、$\text{Hf}{{\text{O}}^{\text{2}+}}$、$\text{C}{{\text{r}}^{\text{3}+}}$;
②“氨沉”时产物为$\text{Zr}{{\left( \text{OH} \right)}_{4}}$、$\text{Cr}{{\left( \text{OH} \right)}_{3}}$和$\text{Fe}{{\left( \text{OH} \right)}_{3}}$;
③$\rm 25\;\rm ^\circ\rm C$时,${{ {K}}_{\text{sp}}}\left[ \text{Fe}{{\left( \text{OH} \right)}_{\text{3}}} \right]={{10}^{-38}}$,${{{K}}_{\text{b}}}\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)=1.8\times {{10}^{-5}}$;
④部分氯化物的沸点数据如表所示:
| 物质 | $\text{ZrC}{{\text{l}}_{4}}$ | $\text{CrC}{{\text{l}}_{3}}$ | $\text{FeC}{{\text{l}}_{3}}$ | $\text{FeC}{{\text{l}}_{2}}$ |
| 沸点$\rm /^\circ\rm C$ | $\rm 331$ | $\rm 1300$ | $\rm 316$ | $\rm 700$ |
回答下列问题:
“碱熔”时有$\text{N}{{\text{a}}_{\text{2}}}\text{Zr}{{\text{O}}_{\text{3}}}$生成,温度和时间对锆英砂碱熔分解率的影响如图所示,则应采取的条件为 。$\text{ZrSi}{{\text{O}}_{\text{4}}}$发生反应的化学方程式为 。
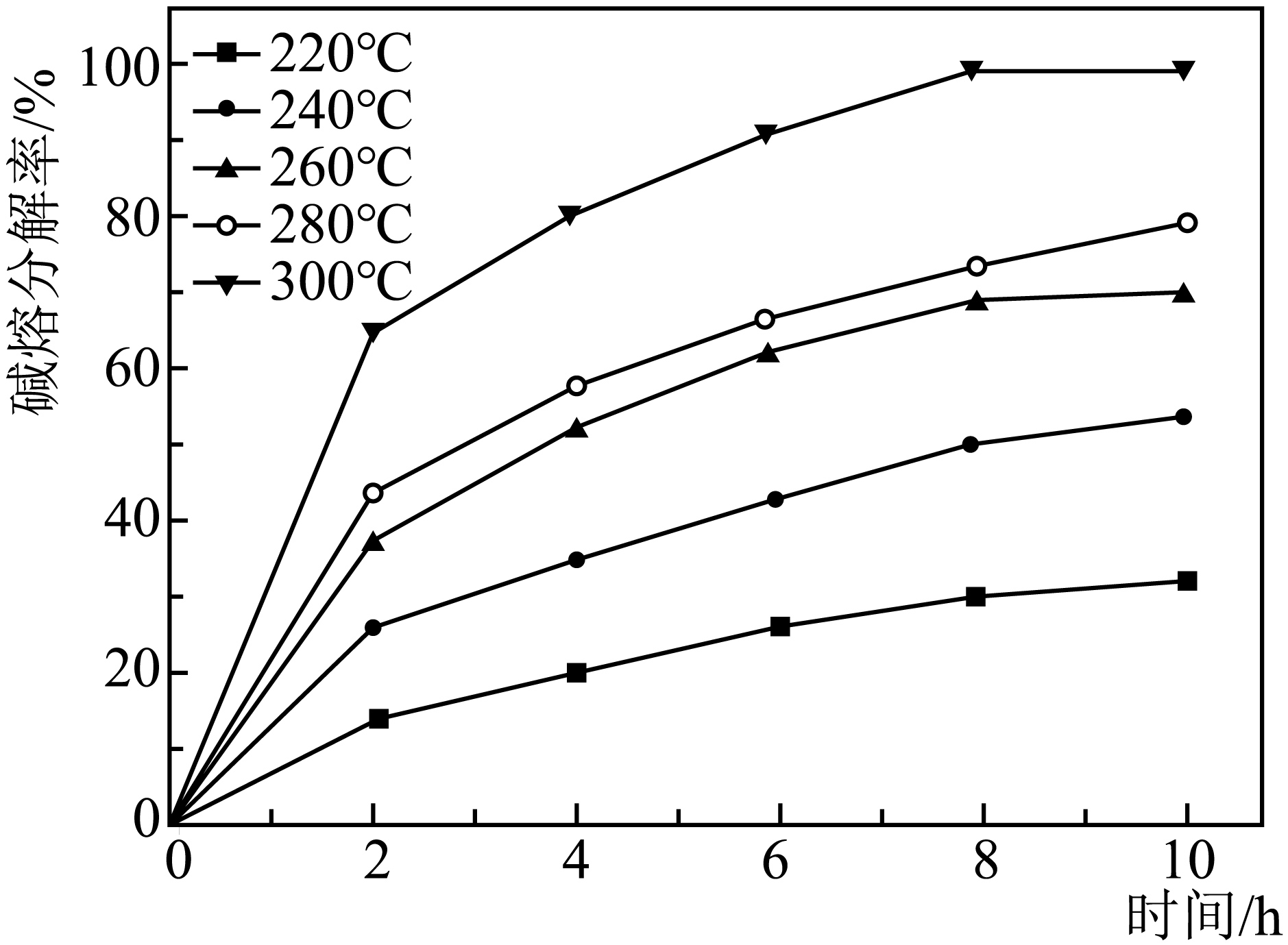
$\\rm 300\\;\\rm ^\\circ\\rm C$条件下碱溶$\\rm 8\\;\\rm h$;$\\text{ZrSi}{{\\text{O}}_{\\text{4}}}+\\text{4NaOH}\\begin{matrix} \\underline{\\underline{\\triangle}} \\\\ {} \\\\ \\end{matrix}\\text{N}{{\\text{a}}_{\\text{2}}}\\text{Zr}{{\\text{O}}_{\\text{3}}}+\\text{N}{{\\text{a}}_{\\text{2}}}\\text{Si}{{\\text{O}}_{\\text{3}}}+\\text{2}{{\\text{H}}_{\\text{2}}}\\text{O}$;
"]]根据温度和时间对锆英砂碱熔分解率的影响图示,$\rm 300\;\rm ^\circ\rm C$碱熔分解率最高, 时间为$\rm 8\;\rm h$和$\rm 10\;\rm h$的分解率没有太大变化,所以最佳的条件是$\rm 300\;\rm ^\circ\rm C$条件下碱熔$\rm 8\;\rm h$。“碱熔”时$\text{ZrSi}{{\text{O}}_{\text{4}}}$与$\rm NaOH$反应生成$\text{N}{{\text{a}}_{\text{2}}}\text{Zr}{{\text{O}}_{\text{3}}}$、硅酸钠,$\text{ZrSi}{{\text{O}}_{\text{4}}}$发生反应的化学方程式为$\text{ZrSi}{{\text{O}}_{\text{4}}}+\text{4NaOH}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\ \end{matrix}\text{N}{{\text{a}}_{\text{2}}}\text{Zr}{{\text{O}}_{\text{3}}}+\text{N}{{\text{a}}_{\text{2}}}\text{Si}{{\text{O}}_{\text{3}}}+\text{2}{{\text{H}}_{\text{2}}}\text{O}$。
“萃取”时除去的杂质元素为 ,流程中可循环利用的物质除$\rm TOPO$外,还有 $\rm ($填化学式$\rm )$。
$\\rm Hf$;$\\rm NaOH$、$\\rm HCl$
"]]“酸溶”后各金属元素在溶液中的存在形式为$\text{Z}{{\text{r}}^{\text{4}+}}$、$\text{F}{{\text{e}}^{\text{3}+}}$、$\text{Hf}{{\text{O}}^{\text{2}+}}$、$\text{C}{{\text{r}}^{\text{3}+}}$;“氨沉”时产物为$\text{Zr}{{\left( \text{OH} \right)}_{4}}$、$\text{Cr}{{\left( \text{OH} \right)}_{3}}$和$\text{Fe}{{\left( \text{OH} \right)}_{3}}$;可知“萃取”时除去的杂质元素为$\rm Hf$;沸腾氯化生成的$\rm HCl$可回到酸溶和反萃取步骤循环利用,除硅产生的滤液$\rm 1$是$\rm NaOH$溶液,可回到碱熔步骤循环利用。
沉氨反应结束后溶液中$\dfrac{c\left( \text{NH}_{4}^{+} \right)}{c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)}=1.8\times {{10}^{5}}$,则$c\left( \text{F}{{\text{e}}^{\text{3}+}} \right)=$ $\text{mol}\cdot {{\text{L}}^{-\text{1}}}$。
${{10}^{-8}}$
"]]${{ {K}}_{\text{b}}}\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)=1.8\times {{10}^{-5}}$,沉氨反应结束后溶液中$\dfrac{c\left( \text{NH}_{4}^{+} \right)}{c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)}=1.8\times {{10}^{5}}$,则$c\rm (OH^{-})=10^{-8}\;\rm mol/L$,则$c\left( \text{F}{{\text{e}}^{\text{3}+}} \right)=\dfrac{{{ {K}}_{\text{sp}}}\left[ \text{Fe}{{\left( \text{OH} \right)}_{\text{3}}} \right]}{{{c}^{3}}\left( \text{O}{{\text{H}}^{-}} \right)}=\dfrac{{{10}^{-38}}}{{{\left( {{10}^{-10}} \right)}^{3}}}={{10}^{-8}}\text{ mol}\cdot {{\text{L}}^{-\text{1}}}$。
“煅烧”时$\text{Zr}{{\left( \text{OH} \right)}_{4}}$分解生成$\text{Zr}{{\text{O}}_{\text{2}}}$,“沸腾氯化”时$\text{Zr}{{\text{O}}_{\text{2}}}$发生反应的化学方程式为: 。氯化反应结束通入${{\text{H}}_{\text{2}}}$,可以将$\text{FeC}{{\text{l}}_{3}}$转为$\text{FeC}{{\text{l}}_{2}}$,其目的是: 。
$\\text{Zr}{{\\text{O}}_{\\text{2}}}+\\text{2C}+\\text{2C}{{\\text{l}}_{\\text{2}}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{ZrC}{{\\text{l}}_{\\text{4}}}+\\text{2CO}$;避免“蒸馏”时$\\text{ZrC}{{\\text{l}}_{\\text{4}}}$中含有$\\text{FeC}{{\\text{l}}_{\\text{3}}}$杂质
"]]“煅烧”时$\text{Zr}{{\left( \text{OH} \right)}_{4}}$分解生成$\text{Zr}{{\text{O}}_{\text{2}}}$,“沸腾氯化”时$\text{Zr}{{\text{O}}_{\text{2}}}$和氯气、$\rm C$反应生成$\rm ZrCl_{4}$和$\rm CO$,发生反应的化学方程式为$\text{Zr}{{\text{O}}_{\text{2}}}+\text{2C}+\text{2C}{{\text{l}}_{\text{2}}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{ZrC}{{\text{l}}_{\text{4}}}+\text{2CO}$。氯化反应结束通入${{\text{H}}_{\text{2}}}$,可以将$\text{FeC}{{\text{l}}_{3}}$转为$\text{FeC}{{\text{l}}_{2}}$,可以避免“蒸馏”时$\text{ZrC}{{\text{l}}_{\text{4}}}$中含有$\text{FeC}{{\text{l}}_{\text{3}}}$杂质。
某种掺杂$\rm CaO$的$\text{Zr}{{\text{O}}_{\text{2}}}$晶胞如图所示,$\rm Ca$位于晶胞的面心。
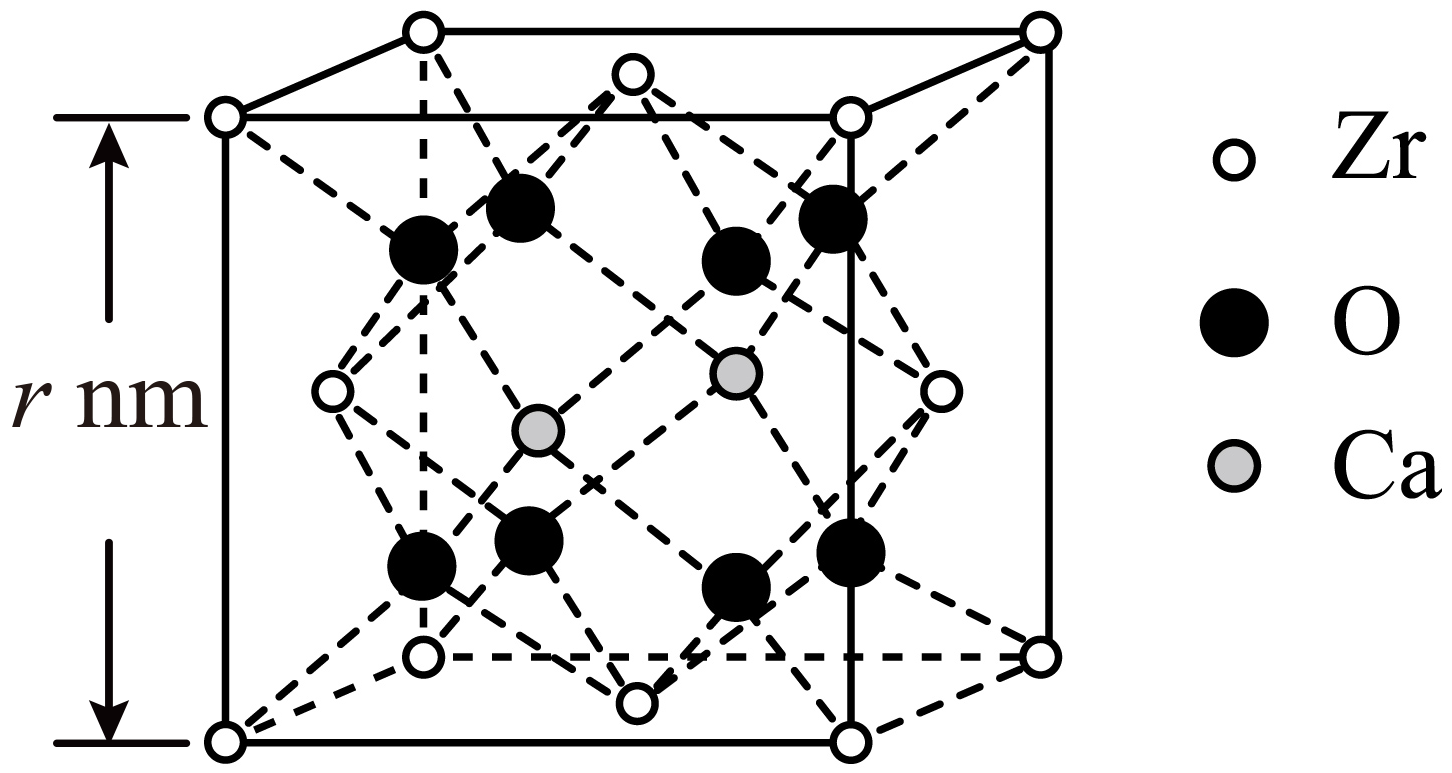
Ⅰ.下列说法正确的是: 。
$\rm a$.已知$\rm Zr$在周期表中与$\rm Ti$同族且相邻,则$\rm Zr$的价电子排布式为:$\rm \text{5}{{\text{s}}^{\text{2}}}\text{4}{{\text{d}}^{\text{2}}}$
$\rm b$.$\rm O$位于$\rm Zr$与$\rm Ca$构成的四面体内部
$\rm c$.每个$\rm O$周围最紧邻的$\rm O$有$\rm 12$个
Ⅱ.结合图中数据,计算该晶胞的密度$\rho =$ $\text{g}\cdot \text{c}{{\text{m}}^{-\text{3}}}\rm ($设${{ {N}}_{\text{A}}}$为阿伏加德罗常数,用含$ r$和${{ {N}}_{\text{A}}}$的代数式表示$\rm )$。
$\\rm b$;$\\dfrac{\\text{441}}{{{ {N}}_{\\text{A}}}{{ {r}}^{\\text{3}}}}\\times {{10}^{21}}$
"]]Ⅰ.$\rm a$.已知$\rm Zr$在周期表中与$\rm Ti$同族且相邻,则$\rm Zr$是第五周期Ⅳ$\rm B$族元素,价电子排布式为:$\rm \text{4}{{\text{d}}^{\text{2}}}\text{5}{{\text{s}}^{\text{2}}}$,故$\rm a$错误;
$\rm b$.根据图示,$\rm O$位于$\rm Zr$与$\rm Ca$构成的四面体内部,故$\rm b$正确;
$\rm c$.$\rm O$位于$\rm Zr$与$\rm Ca$构成的四面体内部,每个$\rm O$周围最紧邻的$\rm O$有$\rm 6$个,故$\rm c$错误;
Ⅱ.根据均摊原则,每个晶胞中$\rm O$原子数为$\rm 8$、$\rm Zr$原子数为$8\times \dfrac{1}{8}+4\times \dfrac{1}{2}=3$、$\rm Ca$原子数为$2\times \dfrac{1}{2}=1$,该晶胞的密度:$\rho =\dfrac{91\times 3+40\times 1+16\times 8}{{{\left( r\times {{10}^{-7}} \right)}^{3}}\times {{N}_{\text{A}}}}=\dfrac{\text{441}}{{{ {N}}_{\text{A}}}{{ {r}}^{\text{3}}}}\times {{10}^{21}}\text{ g}\cdot \text{c}{{\text{m}}^{-\text{3}}}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
