高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
某同学欲在实验室制备消毒剂亚氯酸钠$\left( \text{NaCl}{{\text{O}}_{2}} \right)$,经查阅资料部分物质性质如下:
①制备$\text{NaCl}{{\text{O}}_{2}}$的反应为$2 \mathrm{ClO}_{2}+\mathrm{H}_{2} \mathrm{O}_{2}+2 \mathrm{NaOH}=2 \mathrm{NaClO}_{2}+2 \mathrm{H}_{2} \mathrm{O}+\mathrm{O}_{2}$,且是放热反应。
②$\text{Cl}{{\text{O}}_{2}}$的浓度较大时易分解爆炸,一般操作时需要控制浓度低于$10\%$。
③$\text{NaCl}{{\text{O}}_{2}}$饱和溶液在温度低于${{38}\;{^\circ }}\text{C}$时析出$\text{NaCl}{{\text{O}}_{2}}\cdot 3{{\text{H}}_{2}}\text{O}$晶体,温度高于${{38}\;{^\circ }}\text{C}$时析出$\text{NaCl}{{\text{O}}_{2}}$晶体,温度高于${{60}\;{^\circ }}\text{C}$时,$\text{NaCl}{{\text{O}}_{2}}$分解成$\text{NaCl}{{\text{O}}_{3}}$和$\text{NaCl}$。
现设计如图装置完成亚氯酸钠的实验室制备$\rm ($夹持装置已略去$\rm )$:
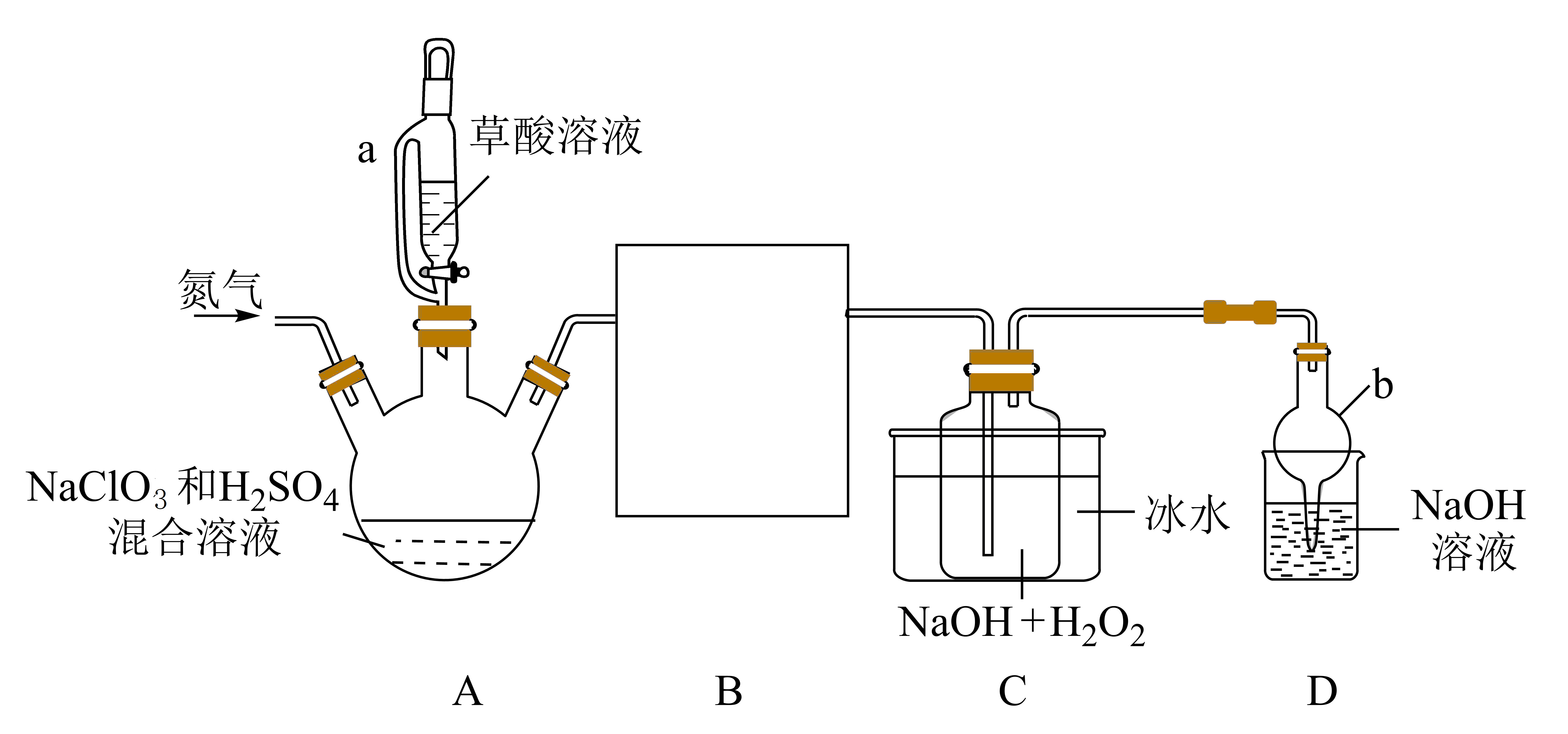
回答下列问题:
从如图选出制备装置中$\operatorname{B}$处所缺的仪器组合 。

$\\rm b$
"]]$\rm ClO_{2}$与$\rm H_{2}O_{2}$、$\rm NaOH$反应,容易发生倒吸现象,则装置$\rm B$的作用是防止倒吸,起到安全瓶的作用,故$\rm B$处所缺的仪器组合为$\rm b$;
制备装置中装草酸溶液的仪器$\rm \operatorname{a}$的名称是 。
恒压滴液漏斗
"]]制备装置中装草酸溶液的仪器$\rm a$的名称是恒压滴液漏斗;
写出$\rm A$装置中生成$\text{Cl}{{\text{O}}_{2}}$的离子方程式 ,实验中通入氮气的目的是 。
$\\text{2ClO}_{3}^{-}+{{\\text{H}}_{2}}{{\\text{C}}_{2}}{{\\text{O}}_{4}}+2{{\\text{H}}^{+}}=2\\text{Cl}{{\\text{O}}_{2}}\\uparrow +2\\text{C}{{\\text{O}}_{\\text{2}}}\\uparrow +2{{\\text{H}}_{\\text{2}}}\\text{O}$;稀释$\\rm ClO_{2}$,防止装置中$\\rm ClO_{2}$的浓度较大而分解爆炸
"]]$\rm NaClO_{3}$具有氧化性,草酸具有还原性,二者在酸性条件下发生氧化还原反应可生成二氧化氯,离子方程式为:$\text{2ClO}_{3}^{-}+{{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}+2{{\text{H}}^{+}}=2\text{Cl}{{\text{O}}_{2}}\uparrow +2\text{C}{{\text{O}}_{\text{2}}}\uparrow +2{{\text{H}}_{\text{2}}}\text{O}$;$\rm ClO_{2}$的浓度较大时易分解爆炸,实验中通入氮气是为了稀释$\rm ClO_{2}$,防止装置中$\rm ClO_{2}$的浓度较大而分解爆炸;
实验中$\operatorname{C}$处冰水浴的目的是 。
降低$\\rm NaClO_{2}$的溶解度、防止$\\rm ClO_{2}$大量逸出
"]]装置$\rm C$中制备$\rm NaClO_{2}$的反应为放热反应,$\rm C$处冰水浴的目的是降低$\rm NaClO_{2}$的溶解度、防止$\rm ClO_{2}$大量逸出;
从装置$\rm C$反应后的溶液中获得$\text{NaCl}{{\text{O}}_{2}}$晶体的操作名称依次为:
$\text{a}.$减压,${{55}\;{^\circ }}\text{C}$蒸发结晶;$\text{b}.\cdots \cdots$;$ \text{c}.$温水洗涤;$\text{d}.$低于${{60}\;{^\circ }}\text{C}$干燥,得到成品。
$\operatorname{b}$的操作名称为 。
趁热过滤
"]]$\text{NaCl}{{\text{O}}_{2}}$饱和溶液在温度低于${{38}\;{^\circ }}\text{C}$时析出$\text{NaCl}{{\text{O}}_{2}}\cdot 3{{\text{H}}_{2}}\text{O}$晶体,温度高于${{38}\;{^\circ }}\text{C}$时析出$\text{NaCl}{{\text{O}}_{2}}$晶体,温度高于${{60}\;{^\circ }}\text{C}$时,$\text{NaCl}{{\text{O}}_{2}}$分解成$\text{NaCl}{{\text{O}}_{3}}$和$\text{NaCl}$,为了得到$\text{NaCl}{{\text{O}}_{2}}$晶体,减压,$\rm 55\;\rm ^\circ\rm C$蒸发结晶后应趁热过滤、用温水洗涤,在低于$\rm 60\;\rm ^\circ\rm C$干燥,得到成品;
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克$\text{C}{{\text{l}}_{2}}$的氧化能力,则$\text{NaCl}{{\text{O}}_{2}}$的有效氯含量为 $\rm ($计算结果保留两位有效数字$\rm )$。
$\\rm 1.6$
"]]氯气和$\rm NaClO_{2}$消毒时均被还原为$\rm Cl^{-}$,$\rm 1\;\rm mol\; Cl_{2}$ 的质量为$\rm 71\;\rm g$,得到的电子的物质的量为$\rm 1\;\rm mol\times 2=2\;\rm mol$,$\rm 1\;\rm mol\; NaClO_{2}$为$\rm 90.5\;\rm g$,得到的电子的物质的量为$\rm 1\;\rm mol\times 4=4\;\rm mol$,则$\rm NaClO_{2}$的有效氯含量为:$\dfrac{71\text{ g}\times 2}{90.5\text{ g}}=1.6$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
